Какой светофильтр лучше использовать в световом микроскопе: Зачем в микроскопах для стоматологии используют световые фильтры
Зачем в микроскопах для стоматологии используют световые фильтры
Зачем в микроскопах для стоматологии используют световые фильтры
Все микроскопы, которые используются в медицине, и стоматологии в частности, обладают специальным держателем для световых фильтров, который находится ниже конденсора. Светофильтры высокого качества являются стеклянными и по своей структуре они есть матовые, цветные или же нейтральные.
Светофильтры помещают под оптический поток света тогда, если есть необходимость обезопасить сетчатку глаза от негативного влияния излучения лазера, или если нужно увеличить или уменьшить степень освещения рабочей зоны или же выделить какою-либо спектральную часть.
Какие существуют типы световых фильтров
- Синие светофильтры, как правило, применяются в определенных сочетаниях вместе с галогеновыми осветителями. Так удаётся добиться такого света, который является наиболее близким к дневному, что позволяет снять чрезмерную нагрузку с глаз исследователя.

- Оранжевый цвет светофильтра является идеальным для проведения лечения. Он позволяет уменьшить скорость полимеризации материалов для пломбировки. Светофильтр такого цвета применяется уже во время использования адгезива.
- Световой фильтр зеленого цвета применяется при оперативных вмешательствах в ротовую полость. Он помогает нейтрализовать красный цвет и в разы лучше рассмотреть как сами зубы, их повреждения, а также сосуды ротовой полости.
- Лазерный светофильтр необходим для того, чтоб уберечь глаза от негативного воздействия лазерного излучения при лечении повреждений с использованием микроскопа и лазера. Подобный фильтр выступает в качестве хорошей защиты от отраженного и рассеянного лазерного излучения от 780нм до 2940нм. Это значит, что он защищает практически от всех используемых сегодня в медицине лазеров.
В конце хочется сказать, что все световые фильтры нужно использовать в случае необходимости. Всё дело в том, что любой дополнительный элемент в оптической системе поглощает лучи света и в результате рабочая зона освещена недостаточно хорошо.
Различные механизмы микроскопов для получения изображений живых клеток
Благодаря растущему числу исследований, использующих методы визуализации живых клеток, и стремительным успехам в области технологии флуоресцентных белков и синтетических флуорофоров, складывается принципиальное понимание природы функционирования клеток и тканей. По существу, визуализация живых клеток стала не только необходимым инструментом в большинстве биологических лабораторий, занимающихся изучением клеток, но и стандартной методикой, применяющейся в различных областях нейробиологии, биологии развития, фармакологии и других биомедицинских дисциплинах.
Моторизированные микроскопы: системы управления затворами, дисками со светофильтрами, фокусировкой, предметным столиком и освещением.
Автоматические компоненты и вспомогательные устройства для микроскопов позволяют автоматизировать процесс получения изображений живых клеток, и особенно удобны в экспериментах с периодической съемкой в заданные временные интервалы, которые могут длиться от миллисекунд до десятков и сотен минут.
Рис. 1. Конфигурация системы для визуализации живых клеток
Сегодня рынок предлагает различные системы (очень дорогие), но, зачастую, стоит вложить в них средства для создания многопользовательской центральной станции. В принципе, затраты можно уменьшить, минимум, на 50%, собрав систему «с нуля». Однако, такие попытки — прерогатива лабораторий, обладающих достаточными знаниями и опытом в оптической микроскопии. Основная проблема создания автоматического микроскопа состоит в объединении разнородных аппаратных и программных компонентов в хорошо координированную, действующую систему. Новейшие микроскопы от ведущих производителей все в большей степени оснащаются современными высокоскоростными затворами, системами коаксиальной фокусировки, устройствами автоматической смены фильтров, средствами управления интенсивностью освещения и его источником, а также другими моторизированными компонентами, интегрированными в единую систему, превосходно работающую под управлением фирменного программного обеспечения.
Основная проблема создания автоматического микроскопа состоит в объединении разнородных аппаратных и программных компонентов в хорошо координированную, действующую систему. Новейшие микроскопы от ведущих производителей все в большей степени оснащаются современными высокоскоростными затворами, системами коаксиальной фокусировки, устройствами автоматической смены фильтров, средствами управления интенсивностью освещения и его источником, а также другими моторизированными компонентами, интегрированными в единую систему, превосходно работающую под управлением фирменного программного обеспечения.
Обобщенная конфигурация системы для визуализации живых клеток, созданная на основе инвертированного микроскопа для наблюдения тканевых культур, представлена на рисунке 1. Все показанные вспомогательные компоненты необходимы для сохранения культуры в процессе получения изображений в режимах светлого поля, фазового контраста, дифференциально-интерференционного контраста и флуоресценции.
Оптические затворы
Электронные затворы используются для блокировки освещения образца в промежутках между получением отдельных снимков (экспозициями), и особенно важны в качестве средств минимизации фотообесцвечивания и фототоксичности при получении изображений чувствительных флуоресцентных образцов.
Несколько более медленный мягкий режим постепенно открывает и закрывает затвор, обеспечивая пониженный уровень вибрации и более тихое срабатывание. Управление интенсивностью освещения без воздействия на длину его волны реализуется в режиме затвора нейтральной плотности. Этот режим дает возможность управлять действующим размером апертуры в открытом состоянии затвора, что позволяет последнему работать в качестве нейтрального светофильтра. Многие контроллеры затворов могут работать в нескольких режимах, и оборудованы интерфейсом с рабочей станцией, что позволяет синхронизировать работу двух и более затворов. Срок службы наиболее надежных затворов исчисляется миллионами рабочих циклов.
Этот режим дает возможность управлять действующим размером апертуры в открытом состоянии затвора, что позволяет последнему работать в качестве нейтрального светофильтра. Многие контроллеры затворов могут работать в нескольких режимах, и оборудованы интерфейсом с рабочей станцией, что позволяет синхронизировать работу двух и более затворов. Срок службы наиболее надежных затворов исчисляется миллионами рабочих циклов.
Рис. 2. Затворы для визуализации живых клеток
На рисунке 2 представлено несколько конструкций затворов, широко распространенных в микроскопии живых клеток. На рисунке 2(a) представлена базовая система затвора в разрезе (рисунок 2(b)), показывающая внутреннее устройство рабочего механизма. При помощи привода с коромыслами, оснащенными демпфирующей системой, состоящей из амортизаторов и фасонной проволочной пружины, лепестки затвора поворачиваются по принципу гильотины и закрывают апертуру. Через электронный интерфейс арматура затвора соединяется с внешним устройством управления, которое может работать как автономно, так и под управлением главного компьютера.
Апертуры затворов для микроскопов имеют диаметр от 25 до 35 миллиметров. Модели с малыми апертурами работают быстрее, но, зачастую, ограничивают поле зрения и, в некоторых микроскопах, могут создавать эффект виньетирования. Затворы с большими апертурами обладают меньшим быстродействием, но уменьшают, либо вовсе устраняют краевые (пограничные) эффекты освещения. Кожух затвора, обычно, вытачивается или отливается из алюминия и анодируется, после чего окрашивается в черный цвет и служит радиатором для обмотки электромагнита привода. Для удобства монтажа многие затворы могут устанавливаться без кожуха, однако, в этом случае лепестки и другие внутренние детали подвергаются воздействию пыли и других загрязняющих веществ. Для минимизации нагревания горячими дуговыми лампами, лепестки затворов для микроскопов должны иметь отражающее покрытие на входной (обращенной к источнику освещения) стороне. Типичное высококачественное отражающее покрытие изготавливается из сплава алюминия и фторида магния, который наносится на бериллиево-медную подложку. Лепестки более дешевых затворов изготавливаются из полированной нержавеющей стали. Последние, в сравнении с лепестками из сплава, обладают меньшей отражающей способностью и хуже рассеивают тепло, зато намного дешевле и более долговечны.
Для минимизации нагревания горячими дуговыми лампами, лепестки затворов для микроскопов должны иметь отражающее покрытие на входной (обращенной к источнику освещения) стороне. Типичное высококачественное отражающее покрытие изготавливается из сплава алюминия и фторида магния, который наносится на бериллиево-медную подложку. Лепестки более дешевых затворов изготавливаются из полированной нержавеющей стали. Последние, в сравнении с лепестками из сплава, обладают меньшей отражающей способностью и хуже рассеивают тепло, зато намного дешевле и более долговечны.
Выбор длины волны
Одним из важнейших компонентов автоматического получения цветных флуоресцентных изображений является устройство, позволяющее быстро переключаться на работу со световыми волнами различной длины. Такое переключение может осуществляться за счет использования нескольких фильтров, светоделительных устройств, направляющих свет по нескольким оптическим путям, монохраматоров или акустооптических настраиваемых фильтров (AOTF). В стандартной конфигурации традиционный набор флуоресцентных фильтров собирается в оптический блок, который содержит фильтр возбуждения и пороговый (или эмиссионный) фильтры, а также дихроичное зеркало, направляющее возбуждающее световое излучение на образец и пропускающее свет к фотоприемнику. В усовершенствованной системе визуализации живых клеток дихроичное зеркало сохраняется, но часто заменяется полихроматическим вариантом с несколькими полосами пропускания. Фильтры для возбуждающего и испускаемого излучения удаляются из оптического блока и устанавливаются в одно (или несколько) описанных далее внешних устройств. В настоящее время применяется несколько механизмов автоматической смены флуоресцентных фильтров. В наиболее распространенном из них используются вращающиеся диски со светофильтрами — надежные, сравнительно недорогие и поддерживаемые (фактически, внедряемые) большим числом программ получения изображений (от производителей, как основного, так и вспомогательного оборудования).
В стандартной конфигурации традиционный набор флуоресцентных фильтров собирается в оптический блок, который содержит фильтр возбуждения и пороговый (или эмиссионный) фильтры, а также дихроичное зеркало, направляющее возбуждающее световое излучение на образец и пропускающее свет к фотоприемнику. В усовершенствованной системе визуализации живых клеток дихроичное зеркало сохраняется, но часто заменяется полихроматическим вариантом с несколькими полосами пропускания. Фильтры для возбуждающего и испускаемого излучения удаляются из оптического блока и устанавливаются в одно (или несколько) описанных далее внешних устройств. В настоящее время применяется несколько механизмов автоматической смены флуоресцентных фильтров. В наиболее распространенном из них используются вращающиеся диски со светофильтрами — надежные, сравнительно недорогие и поддерживаемые (фактически, внедряемые) большим числом программ получения изображений (от производителей, как основного, так и вспомогательного оборудования). Основной недостаток таких дисков состоит в ограничении скорости переключения. Среди основных преимуществ дисков для светофильтров следует отметить их высокое светопропускание и универсальность, позволяющую использовать их с широким спектром имеющихся в продаже светофильтров.
Основной недостаток таких дисков состоит в ограничении скорости переключения. Среди основных преимуществ дисков для светофильтров следует отметить их высокое светопропускание и универсальность, позволяющую использовать их с широким спектром имеющихся в продаже светофильтров.
Такие диски предназначены для крепления от 4-х до 10-и круглых плоских оптических интерференционных светофильтров, а также нейтральных, тепловых и ультрафиолетовых светофильтров диаметром от 25 до 50 миллиметров (см. рисунки 3 и 4). Диск монтируется в алюминиевом кожухе, обеспечивающем легкий доступ к фильтрам в случае их замены, и приводится в движение прецизионным шаговым двигателем, который, в свою очередь, управляется внешним устройством (см. рисунок 4(a)). В кожухе имеется оптический порт (в который последовательно можно установить любой фильтр) для соединения (через специальные адаптеры) с микроскопом и источником освещения. Кроме того, многодисковые кожухи могут оснащаться затворами с болтовым креплением. Высококачественные диски для светофильтров оснащаются монтажными проушинами, что позволяет надежно крепить их на оптической скамье или на виброизолирующем столе. Некоторые диски оборудуются сменными или вставными держателями для дополнительных (например, нейтральных) светофильтров, которые устанавливаются последовательно с интерференционными фильтрами, находящимися непосредственно в диске. Модуль управления диском со светофильтрами может, в свою очередь, управляться встроенным микропроцессором и работать, как автономное устройство, либо может подсоединяться к рабочей станции, управляющей несколькими дисками со светофильтрами, затворами, цифровыми камерами и другими периферийными устройствами.
Высококачественные диски для светофильтров оснащаются монтажными проушинами, что позволяет надежно крепить их на оптической скамье или на виброизолирующем столе. Некоторые диски оборудуются сменными или вставными держателями для дополнительных (например, нейтральных) светофильтров, которые устанавливаются последовательно с интерференционными фильтрами, находящимися непосредственно в диске. Модуль управления диском со светофильтрами может, в свою очередь, управляться встроенным микропроцессором и работать, как автономное устройство, либо может подсоединяться к рабочей станции, управляющей несколькими дисками со светофильтрами, затворами, цифровыми камерами и другими периферийными устройствами.
Для поворота и установки очередного светофильтра в оптический порт стандартному недорогому диску требуется до 100 миллисекунд, тогда как более дорогие и быстродействующие диски выполняют эту операцию, приблизительно, за 25 миллисекунд. Хотя, на первый взгляд такие скорости и могут показаться достаточно высокими, при скорости переключения 100 миллисекунд для регистрации аксиальной серии из 20-и оптических срезов на двух длинах волн, на переключение требуется, в сумме, минимум, 4 секунды, что сильно ограничивает скорость получения изображений быстрых клеточных процессов. Кроме того, диски со светофильтрами способны создавать механические вибрации, которые через штатив микроскопа могут достигать фотоприемника и ухудшать качество изображения. Установленные непосредственно на корпусе микроскопа, диски со светофильтрами и затворы во время работы способны создавать вибрации, которые могут длиться сотни миллисекунд. Это обстоятельство может серьезно снизить разрешение изображений.
Кроме того, диски со светофильтрами способны создавать механические вибрации, которые через штатив микроскопа могут достигать фотоприемника и ухудшать качество изображения. Установленные непосредственно на корпусе микроскопа, диски со светофильтрами и затворы во время работы способны создавать вибрации, которые могут длиться сотни миллисекунд. Это обстоятельство может серьезно снизить разрешение изображений.
Рис. 3.Конфигурации дисков со светофильтрами и затворов для ослабления вибрационных искажений
Проблемы вибрации присущи и серийно выпускающимися микроскопами научно-исследовательского уровня, которые могут содержать целый ряд моторизированных компонентов. Стремясь уменьшить такие вибрации, производители часто ограничивают скорость работы навесных устройств (приводов координатных перемещений, револьверных держателей и конденсоров), либо вводят задержку по времени между моментом остановки двигателя и началом формирования изображения. К сожалению, во многих случаях такие задержки снижают общее быстродействие системы и часто подвергают образец ненужному облучению чрезмерным количеством света. Производители также расширяют номенклатуру своих изделий, включая в нее автоматические затворы, диски для светофильтров, кубические блоки с флуоресцентными фильтрами, контроллеры портов и родственные принадлежности, с управлением всеми перечисленными устройствами от одного контроллера. Эти периферийные устройства позволяют быстро, автоматически переключаться из одного режима наблюдения в другой, и идеально подходят к микроскопам, конфигурированным для визуализации живых клеток. Из числа новых опций предлагается парфокальная компенсация — для согласования фокусной точки при смене объективов, средства регулировки чувствительности — для механизмов тонкой фокусировки и координация автоматических функций — для обеспечения бесперебойного выполнения запрограммированных временных последовательностей.
К сожалению, во многих случаях такие задержки снижают общее быстродействие системы и часто подвергают образец ненужному облучению чрезмерным количеством света. Производители также расширяют номенклатуру своих изделий, включая в нее автоматические затворы, диски для светофильтров, кубические блоки с флуоресцентными фильтрами, контроллеры портов и родственные принадлежности, с управлением всеми перечисленными устройствами от одного контроллера. Эти периферийные устройства позволяют быстро, автоматически переключаться из одного режима наблюдения в другой, и идеально подходят к микроскопам, конфигурированным для визуализации живых клеток. Из числа новых опций предлагается парфокальная компенсация — для согласования фокусной точки при смене объективов, средства регулировки чувствительности — для механизмов тонкой фокусировки и координация автоматических функций — для обеспечения бесперебойного выполнения запрограммированных временных последовательностей.
Большая часть находящихся в эксплуатации микроскопов предыдущих поколений не позволяет реализовывать преимущества новейших автоматических периферийных устройств, и владельцы таких микроскопов вынуждены полагаться на вторичный рынок запчастей. При использовании вспомогательных устройств целесообразно установить блок осветителя, диски для светофильтров и затворы на отдельную от микроскопа стойку, чтобы исключить вибрации и реализовать синхронизацию устройств без необходимости введения временнóй задержки. В большинстве случаев, сложность подсоединения периферийных устройств требует прецизионной юстировки компонентов.
При использовании вспомогательных устройств целесообразно установить блок осветителя, диски для светофильтров и затворы на отдельную от микроскопа стойку, чтобы исключить вибрации и реализовать синхронизацию устройств без необходимости введения временнóй задержки. В большинстве случаев, сложность подсоединения периферийных устройств требует прецизионной юстировки компонентов.
Поэтому, лучше всего установить всю систему на изолированном от вибраций столе или на оборудованной амортизаторами лабораторной платформе. Такие платформы с резьбовыми отверстиями, расположенными с интервалом в 1 дюйм, имеются в продаже. На рисунке 3 представлены рекомендуемые конфигурации диска со светофильтрами и затвора, предназначенные для уменьшения вибрационных искажений. Все, показанные на рисунке, детали прочно закреплены на лабораторной панели или на изолирующем столе. С целью снижения вибрационного воздействия диск со светофильтрами отделен от микроскопа и цифровой камеры воздушными зазорами шириной 1 мм.![]() Коллиматор осветителя на рисунке 3(a) соединен непосредственно с затвором, заключенным в кожух диска со светофильтрами, и опирается на алюминиевые стойки. Зазор между затвором и масштабирующим переходником предотвращает нарушение равновесия микроскопа быстрыми движениями створок затвора. Аналогично, диск для светофильтров в конфигурации, представленной на рисунке 3(b), также отделен от штатива микроскопа и от камеры воздушным зазором.
Коллиматор осветителя на рисунке 3(a) соединен непосредственно с затвором, заключенным в кожух диска со светофильтрами, и опирается на алюминиевые стойки. Зазор между затвором и масштабирующим переходником предотвращает нарушение равновесия микроскопа быстрыми движениями створок затвора. Аналогично, диск для светофильтров в конфигурации, представленной на рисунке 3(b), также отделен от штатива микроскопа и от камеры воздушным зазором.
При установке диска со светофильтрами на порт испускаемого излучения микроскопа предыдущего поколения, возникает еще одна проблема. Эта проблема заключается в потенциальном нарушении парфокальности, отклонения от выбранной полосы пропускания (волн соответствующей длины) и возникновения аберраций из-за введения плоских оптических пластин в выходящий из микроскопа сфокусированный световой поток. . Установка фильтра излучения в выходной световой пучок микроскопов некоторых конфигураций может вызывать сдвиг фокальной плоскости. Степень такого сдвига зависит от толщины и показателя преломления устанавливаемого фильтра. Кроме того, проходя через полосовой интерференционный фильтр под различными углами, сфокусированный световой поток может вносить изменения в значение центральной длины волны полосы пропускания (зоны прозрачности) для различных составляющих светового потока. Эти смещения легко компенсируются дополнительными адаптерами, которые создают коллимированное пространство (бесконечность) в порту (микроскопа) для испускаемого излучения, что позволяет устанавливать диски со светофильтрами и другие оптические устройства в параллельный, создаваемый адаптером путь прохождения света.
Кроме того, проходя через полосовой интерференционный фильтр под различными углами, сфокусированный световой поток может вносить изменения в значение центральной длины волны полосы пропускания (зоны прозрачности) для различных составляющих светового потока. Эти смещения легко компенсируются дополнительными адаптерами, которые создают коллимированное пространство (бесконечность) в порту (микроскопа) для испускаемого излучения, что позволяет устанавливать диски со светофильтрами и другие оптические устройства в параллельный, создаваемый адаптером путь прохождения света.
В качестве альтернативы дискам со светофильтрами были разработаны системы, позволяющие получать цветные изображения или выполнять спектральное разделение одновременно с линейным разделением, без смены светофильтров и с использованием одного фотоприемника цифровой камеры. Преимущество таких систем состоит в исключении искажений, связанных с движущимися деталями, которые часто возникают при использовании дисков со светофильтрами во время последовательной съемки, а также в обеспечении превосходной регистрации изображений. Многоканальные системы весьма удобны для проведения количественных экспериментов с многоцветной визуализацией (таких, как резонансный перенос энергии), где искажение в регистрации сигнала всего лишь одной ячейки (пикселя) может привести к значительным ошибкам. К недостаткам таких систем можно отнести ограниченную пропускную способность фильтра и сокращение эффективной, формирующей изображения области датчика, которая уменьшается наполовину или на четверть (в зависимости от конфигурации внутреннего светоделителя и пропускной способности фильтра). В новых многоканальных системах пространственные ограничения частично устранены за счет разделения и направления светового потока на два раздельных фотоприемника (цифровые камеры), каждый из которых оборудован независимым фильтрующим каналом и системой тонкой фокусировки, для обеспечения уверенной регистрации пикселей.
Многоканальные системы весьма удобны для проведения количественных экспериментов с многоцветной визуализацией (таких, как резонансный перенос энергии), где искажение в регистрации сигнала всего лишь одной ячейки (пикселя) может привести к значительным ошибкам. К недостаткам таких систем можно отнести ограниченную пропускную способность фильтра и сокращение эффективной, формирующей изображения области датчика, которая уменьшается наполовину или на четверть (в зависимости от конфигурации внутреннего светоделителя и пропускной способности фильтра). В новых многоканальных системах пространственные ограничения частично устранены за счет разделения и направления светового потока на два раздельных фотоприемника (цифровые камеры), каждый из которых оборудован независимым фильтрующим каналом и системой тонкой фокусировки, для обеспечения уверенной регистрации пикселей.
Рис. 4. Конфигурация двухканальной системы получения изображений с дисками со светофильтрами
Представленные на рисунке 4 устройства для переключения длин волн работают по принципу вращения диска со светофильтрами и установки на оптическом пути света нового интерференционного фильтра (рисунок 4(a)), либо по принципу направления испускаемого света по отдельным оптическим путям (рисунки 4(b) и 4 (с)). На рисунке 4(a) представлен стандартный диск, вмещающий до 10 отдельных светофильтров. Диск управляется внешним устройством (не показано) и способен переключать систему с одного фильтра на другой в течение 25 — 40 миллисекунд. К преимуществам таких дисков можно отнести возможность быстро менять наборы фильтров и бесчисленные конфигурационные возможности, как для возбуждающего, так и для испускаемого светового излучения. На рисунке 4 (с) представлена оптическая система двухканального устройства визуализации (рисунок 4(b)). Такие многоканальные системы для получения изображений пользуются растущей популярностью, в качестве альтернативы дискам со светофильтрами, и подробно описаны в последующих разделах.
На рисунке 4(a) представлен стандартный диск, вмещающий до 10 отдельных светофильтров. Диск управляется внешним устройством (не показано) и способен переключать систему с одного фильтра на другой в течение 25 — 40 миллисекунд. К преимуществам таких дисков можно отнести возможность быстро менять наборы фильтров и бесчисленные конфигурационные возможности, как для возбуждающего, так и для испускаемого светового излучения. На рисунке 4 (с) представлена оптическая система двухканального устройства визуализации (рисунок 4(b)). Такие многоканальные системы для получения изображений пользуются растущей популярностью, в качестве альтернативы дискам со светофильтрами, и подробно описаны в последующих разделах.
Многоканальные системы визуализации коллимируют и пропускают световой поток выходного порта микроскопа через одиночное дихроичное зеркало, которое расщепляет падающий луч на две независимые и спектрально различные составляющие (лучи) (см. рисунок 4 (с)). Один из лучей содержит волны с длинами, меньшими, а второй — с большими, чем «точка отрезания» зеркала. Два полученных луча проходят через оптическую систему, и могут быть скорректированы в отношении спектрального состава, интенсивности и поляризации путем пропускания через соответствующий фильтр. После фильтрации лучи проходят через общую линзу-формирователь изображений, и создают на воспринимающей поверхности фотоприемника два пространственно разделенных и спектрально различных изображения. Каждое из изображений проецируется на половину матрицы фотоприемника. В системах, разделяющих исходный световой поток на четыре луча, одиночное дихроичное зеркало заменяется зеркалом с тремя полосами пропускания. В остальном, система работает аналогично двухканальной.
Два полученных луча проходят через оптическую систему, и могут быть скорректированы в отношении спектрального состава, интенсивности и поляризации путем пропускания через соответствующий фильтр. После фильтрации лучи проходят через общую линзу-формирователь изображений, и создают на воспринимающей поверхности фотоприемника два пространственно разделенных и спектрально различных изображения. Каждое из изображений проецируется на половину матрицы фотоприемника. В системах, разделяющих исходный световой поток на четыре луча, одиночное дихроичное зеркало заменяется зеркалом с тремя полосами пропускания. В остальном, система работает аналогично двухканальной.
Изменив конструкцию, выходные лучи многоканальной системы можно направить на две камеры (как уже упоминалось), и получить два изображения, используя всю матрицу фотоприемника, в тех случаях, когда требуется полное поле зрения. Объединенную со щелевой системой и автоматически перемещаемым предметным столиком, многоканальную систему можно адаптировать для исследований со спектральной визуализацией. Одно из главных преимуществ многоканальных систем визуализации состоит в отсутствии задержек при получении изображений и потенциальных проблем с вибрацией, создаваемой вращающимся диском со светофильтрами. Таким образом, любая задержка, связанная с получением изображений, обусловлена ограничениями, накладываемыми скоростью считывания, которой обладает фотоприемник. В сочетании с электронно-умножающими камерами (EMCCD), способными на высокоскоростное считывание при очень низких уровнях освещенности, многоканальные системы получения изображений дают возможность регистрировать внутриклеточные явления, протекающие за значительно меньшие промежутки времени, чем те, которые позволяют регистрировать дисковые системы со светофильтрами.
Одно из главных преимуществ многоканальных систем визуализации состоит в отсутствии задержек при получении изображений и потенциальных проблем с вибрацией, создаваемой вращающимся диском со светофильтрами. Таким образом, любая задержка, связанная с получением изображений, обусловлена ограничениями, накладываемыми скоростью считывания, которой обладает фотоприемник. В сочетании с электронно-умножающими камерами (EMCCD), способными на высокоскоростное считывание при очень низких уровнях освещенности, многоканальные системы получения изображений дают возможность регистрировать внутриклеточные явления, протекающие за значительно меньшие промежутки времени, чем те, которые позволяют регистрировать дисковые системы со светофильтрами.
Визуализация живых клеток в конфокальной и многофотонной микроскопии ограничивается спектральными линиями излучения лазерной системы, подключенной к прибору. В конечном итоге, принцип селекции длин волн в широкопольной микроскопии, в системах с вращающимися дисками и разверткой поля, а также во флуоресцентной микроскопии полного внутреннего отражения (TIRF белого света) может привести, по меньшей мере, в большинстве самых передовых приложений, к переходу от полосовых интерференционных фильтров к перестраиваемым монохроматорам, жидкокристаллическим (LCTF) и акустооптическим (AOTF) фильтрам. В монохроматорах для оптической микроскопии используется комбинация дуговой лампы (обычно, ксеноновой), частотно-селективной пластины на базе дифракционной решетки и конденсорной системы осветителя, направляющей свет в микроскоп (см. рисунок 8(d)). Контролируемые быстродействующими гальванометрами, управляющими положением входной щели и дифракционной решетки, эти устройства способны за миллисекунды и с прецизионной точностью изменять длину волны и полосу пропускания. Жидкокристаллические перестраиваемые фильтры (LCTF) характеризуются высокой разрешающей способностью, апертурой большого диаметра, отсутствием ошибок регистрации изображений и приемлемой скоростью, и могут применяться в исследованиях со спектральной визуализацией. С другой стороны, ЖК перестраиваемые фильтры обладают ограниченным спектральным диапазоном, неустойчивыми полосами пропускания, низким светопропусканием (обычно, 30% на фильтр) и требуют удлинения оптического пути. Акустооптические перестраиваемые фильтры являются «рабочей лошадкой» для частотной селекции в конфокальной микроскопии, но пока не нашли широкого применения в других режимах визуализации.
В монохроматорах для оптической микроскопии используется комбинация дуговой лампы (обычно, ксеноновой), частотно-селективной пластины на базе дифракционной решетки и конденсорной системы осветителя, направляющей свет в микроскоп (см. рисунок 8(d)). Контролируемые быстродействующими гальванометрами, управляющими положением входной щели и дифракционной решетки, эти устройства способны за миллисекунды и с прецизионной точностью изменять длину волны и полосу пропускания. Жидкокристаллические перестраиваемые фильтры (LCTF) характеризуются высокой разрешающей способностью, апертурой большого диаметра, отсутствием ошибок регистрации изображений и приемлемой скоростью, и могут применяться в исследованиях со спектральной визуализацией. С другой стороны, ЖК перестраиваемые фильтры обладают ограниченным спектральным диапазоном, неустойчивыми полосами пропускания, низким светопропусканием (обычно, 30% на фильтр) и требуют удлинения оптического пути. Акустооптические перестраиваемые фильтры являются «рабочей лошадкой» для частотной селекции в конфокальной микроскопии, но пока не нашли широкого применения в других режимах визуализации. Прежде, чем эти устройства можно будет повсеместно использовать для визуализации живых клеток при помощи широкопольных флуоресцентных микроскопов, необходимо устранить такие их недостатки, как узкая полоса пропускания, низкая разрешающая способность, размывание изображения и т. д.
Прежде, чем эти устройства можно будет повсеместно использовать для визуализации живых клеток при помощи широкопольных флуоресцентных микроскопов, необходимо устранить такие их недостатки, как узкая полоса пропускания, низкая разрешающая способность, размывание изображения и т. д.
Механизм фокусировки и перемещения предметного столика
Двигатели механизмов фокусировки соединяются с редуктором механизма, который, под управлением компьютерной программы получения изображений, автоматически осуществляет точную фокусировку микроскопа. Эти устройства можно использовать совместно с программными функциями автоматической фокусировки, либо для получения набора оптических срезов для последующего деконволюционного анализа и/или воссоздания трехмерного изображения. Моторизированные предметные столики, используемые совместно с программным обеспечением (ПО) для визуализации, можно автоматически перемещать из одного поля обзора в другое, либо между лунками чашки для культивирования. Чтобы получить набор изображений осевых срезов (так называемую z-серию изображений), механизм тонкой фокусировки объектива микроскопа должен, под управлением ПО для визуализации, пошагово и с прецизионными интервалами переместить фокальную плоскость через весь образец. Производители микроскопов и дополнительного оборудования предлагают множество различных моторизированных ступенчатых (шаговых) устройств фокусировки, которые перемещают целиком весь револьвер объективов либо предметный столик микроскопа. В качестве альтернативы, в револьверном держателе можно установить пьезоэлектрическое устройство, которое будет перемещать вверх и вниз вдоль оптической оси микроскопа только один объектив. Основным преимуществом шаговых двигателей является их дешевизна и практически неограниченная длина перемещения рабочего органа, что обеспечивает дополнительные возможности контроля над процессом получения «стопок» изображений. Кроме того, поскольку шаговые двигатели предназначены для использования с редуктором приводного механизма микроскопа, они позволяют автоматически фокусировать любой из объективов, установленных в револьверном держателе.
Чтобы получить набор изображений осевых срезов (так называемую z-серию изображений), механизм тонкой фокусировки объектива микроскопа должен, под управлением ПО для визуализации, пошагово и с прецизионными интервалами переместить фокальную плоскость через весь образец. Производители микроскопов и дополнительного оборудования предлагают множество различных моторизированных ступенчатых (шаговых) устройств фокусировки, которые перемещают целиком весь револьвер объективов либо предметный столик микроскопа. В качестве альтернативы, в револьверном держателе можно установить пьезоэлектрическое устройство, которое будет перемещать вверх и вниз вдоль оптической оси микроскопа только один объектив. Основным преимуществом шаговых двигателей является их дешевизна и практически неограниченная длина перемещения рабочего органа, что обеспечивает дополнительные возможности контроля над процессом получения «стопок» изображений. Кроме того, поскольку шаговые двигатели предназначены для использования с редуктором приводного механизма микроскопа, они позволяют автоматически фокусировать любой из объективов, установленных в револьверном держателе. Основным недостатком шаговых двигателей, в сравнении с пьезоэлектрическими устройствами, является меньшее быстродействие и значительно больший гистерезис. Самый высокоскоростной метод получения z-последовательностей обеспечивают пьезоэлектрические устройства, обладающие большей точностью и скоростью, нежели шаговые двигатели. Однако, пьезоэлектрические приводы имеют ограниченное расстояние перемещения (100 — 200 микрон) и более высокую стоимость.
Основным недостатком шаговых двигателей, в сравнении с пьезоэлектрическими устройствами, является меньшее быстродействие и значительно больший гистерезис. Самый высокоскоростной метод получения z-последовательностей обеспечивают пьезоэлектрические устройства, обладающие большей точностью и скоростью, нежели шаговые двигатели. Однако, пьезоэлектрические приводы имеют ограниченное расстояние перемещения (100 — 200 микрон) и более высокую стоимость.
Рис. 5. Конструкция прецизионного моторизированного предметного столика
На рисунке 5 представлен высококачественный моторизированный предметный столик с камерой для визуализации живых клеток. Моторизированные столики очень удобны для компенсации поперечного дрейфа и получения последовательных изображений двух и более полей обзора во время выполнения последовательности съемки в заданные моменты времени. Сегодня рынок предлагает моторизированные предметные столики с шаговыми двигателями постоянного тока (DC) или с серводвигателями. Серводвигатели, обычно, обладают бóльшими скоростями перемещения, чем шаговые (зачастую, в два раза). Возможность точно контролировать положение (и его повторяемость) предметного столика зависит от системы обратной связи с кодовым датчиком положения (энкодером). Этот же датчик определяет разрешение при перемещении предметного столика. Основное преимущество шаговых двигателей, в сравнении с серводвигателями, состоит в надежности и превосходном управлении на малых скоростях. Диапазон перемещения стандартного предметного столика составляет 2 — 4 дюйма в обоих направлениях — x и y. Энкодеры большинства предметных столиков обладают разрешающей способностью от 40 до 100 нанометров и обеспечивают повторяемость (способность возвращаться в ранее занимаемое положение) от 300 до 750 нанометров. В большинстве своем, моторизированные предметные столики позволяют устанавливать на них весь спектр держателей образцов, в том числе многолуночные пластины, колбы, чашки Петри и стандартные предметные стекла для микроскопов.
Серводвигатели, обычно, обладают бóльшими скоростями перемещения, чем шаговые (зачастую, в два раза). Возможность точно контролировать положение (и его повторяемость) предметного столика зависит от системы обратной связи с кодовым датчиком положения (энкодером). Этот же датчик определяет разрешение при перемещении предметного столика. Основное преимущество шаговых двигателей, в сравнении с серводвигателями, состоит в надежности и превосходном управлении на малых скоростях. Диапазон перемещения стандартного предметного столика составляет 2 — 4 дюйма в обоих направлениях — x и y. Энкодеры большинства предметных столиков обладают разрешающей способностью от 40 до 100 нанометров и обеспечивают повторяемость (способность возвращаться в ранее занимаемое положение) от 300 до 750 нанометров. В большинстве своем, моторизированные предметные столики позволяют устанавливать на них весь спектр держателей образцов, в том числе многолуночные пластины, колбы, чашки Петри и стандартные предметные стекла для микроскопов. Кроме того, на многие предметные столики можно устанавливать адаптеры камер с контролируемой окружающей средой для визуализации живых клеток. Для моторизированных предметных столиков требуется отдельное устройство управления (контроллер), которое, обычно, оснащается манипулятором (джойстиком) для управления координатным перемещением. Этот контроллер может быть выполнен в виде автономного устройства, либо работать под управлением главного компьютера (через интерфейсы RS-232 или USB) в единой системе вспомогательных устройств.
Кроме того, на многие предметные столики можно устанавливать адаптеры камер с контролируемой окружающей средой для визуализации живых клеток. Для моторизированных предметных столиков требуется отдельное устройство управления (контроллер), которое, обычно, оснащается манипулятором (джойстиком) для управления координатным перемещением. Этот контроллер может быть выполнен в виде автономного устройства, либо работать под управлением главного компьютера (через интерфейсы RS-232 или USB) в единой системе вспомогательных устройств.
Одной из наиболее серьезных и часто встречающихся проблем в микроскопии с получением изображений живых клеток в течение заданного интервала времени, являются флуктуации положения фокальной плоскости микроскопа по оси. Часто называемое дрейфом фокусировки, изменение положения фокальной плоскости микроскопа обусловлено, обычно, колебаниями температуры в камере для образца или в помещении, где установлен микроскоп. Сегодня производители микроскопов и дополнительного оборудования предлагают целый ряд программных и аппаратных средств для борьбы с дрейфом фокусировки. Одними из аппаратных средств являются системы автоматической фокусировки, основанные на принципе измерения расстояния между передней линзой объектива и образцом за счет обнаружения световых или звуковых колебаний, отраженных от нижней поверхности покровного стекла (ближайшей к объективу поверхности). Однако, при использовании иммерсионных объективов с высоким разрешением, этот метод может оказаться неработоспособным из-за потери контрастности и отражательной способности при прохождении света (из системы измерения расстояния) через масло. В наиболее современных системах автоматической фокусировки в качестве источника излучения используется лазер низкой интенсивности ближнего инфракрасного диапазона или светоизлучающий диод (СИД). Излучение от такого источника направляется через объектив на верхнюю поверхность покровной пластины (сторона с клетками, погруженная в культуральную среду), отражается от этой поверхности, после чего собирается объективом и направляется на фотоприемник системы (цепи обратной связи), управляющей положением объектива относительно границы раздела «покровное стекло-культуральная среда».
Одними из аппаратных средств являются системы автоматической фокусировки, основанные на принципе измерения расстояния между передней линзой объектива и образцом за счет обнаружения световых или звуковых колебаний, отраженных от нижней поверхности покровного стекла (ближайшей к объективу поверхности). Однако, при использовании иммерсионных объективов с высоким разрешением, этот метод может оказаться неработоспособным из-за потери контрастности и отражательной способности при прохождении света (из системы измерения расстояния) через масло. В наиболее современных системах автоматической фокусировки в качестве источника излучения используется лазер низкой интенсивности ближнего инфракрасного диапазона или светоизлучающий диод (СИД). Излучение от такого источника направляется через объектив на верхнюю поверхность покровной пластины (сторона с клетками, погруженная в культуральную среду), отражается от этой поверхности, после чего собирается объективом и направляется на фотоприемник системы (цепи обратной связи), управляющей положением объектива относительно границы раздела «покровное стекло-культуральная среда».
Предлагаемые сегодня системы автоматической фокусировки способны компенсировать дрейф фокусировки, обусловленный флуктуациями температуры (см. выше), плотности и вязкости иммерсионной среды, а также вибрациями. Наиболее совершенные системы работают по принципу непрерывного сравнения получаемого изображения и текущего аксиального (продольного) положения со сформированным в процессе настройки эталонным изображением. В качестве эталона, обычно, берется полученный от покровного стекла рисунок отражений, интенсивность которого легко измерить при помощи специальной сенсорной схемы. Система контроля аксиального положения компенсирует температурный и механический дрейф и перемещает покровное стекло в первоначальную фокальную плоскость, обеспечивая точную фокусировку («резкий фокус» или «резкость»). Оператор может определить характерное значение (называемое смещением) для требуемой аксиальной фокусировки, которая часто отклоняется от точного положения границы между покровным стеклом и водной культуральной тканевой средой или буферным раствором. Системы автоматической фокусировки способны корректировать дрейф фокусного расстояния за миллисекунды — очевидное преимущество над программно-реализованными алгоритмами, которые для этого, зачастую, требуют нескольких секунд (и могут приводить к значительным уровням фототоксичности и фотообесцвечивания).
Системы автоматической фокусировки способны корректировать дрейф фокусного расстояния за миллисекунды — очевидное преимущество над программно-реализованными алгоритмами, которые для этого, зачастую, требуют нескольких секунд (и могут приводить к значительным уровням фототоксичности и фотообесцвечивания).
При оценке систем автоматической фокусировки, среди прочих параметров, следует рассмотреть их способность обрабатывать сложное изображение с множеством деталей, находящихся в нескольких аксиальных и латеральных положениях на одном образце. Не менее важными характеристиками являются частота и точность коррекции фокусировки, а также режим работы — непрерывная компенсация, или же коррекция непосредственно перед съемкой каждого изображения. Каждый подход обладает своими преимуществами. Для наблюдений в реальном времени больше подходят системы с постоянной обратной связью, нежели те, которые работают независимо от программного запроса. Однако, когда главной целью эксперимента является получение изображений, предпочтительно включать систему автофокусировки непосредственно перед получением снимка, по причине жесткой необходимости синхронизировать получение снимка с определением опорной точки (выполняется при каждой оценке фокусировки, с целью определения наличия или отсутствия дрейфа). В экспериментах со съемками в заданные моменты времени, когда между получением снимков проходит значительное количество времени, короткий промежуток, необходимый для измерения положения фокальной точки, не имеет значения. С другой стороны, при высокоскоростной съемке (от 2 до 30 кадров в секунду) последовательностей изображений, системы автофокусировки могут создавать искажение под названием дрожание. Это искажение возникает вследствие попытки системы автофокусировки скорректировать фокусировку путем самопроизвольного перемещения предметного столика во время получения снимка.
В экспериментах со съемками в заданные моменты времени, когда между получением снимков проходит значительное количество времени, короткий промежуток, необходимый для измерения положения фокальной точки, не имеет значения. С другой стороны, при высокоскоростной съемке (от 2 до 30 кадров в секунду) последовательностей изображений, системы автофокусировки могут создавать искажение под названием дрожание. Это искажение возникает вследствие попытки системы автофокусировки скорректировать фокусировку путем самопроизвольного перемещения предметного столика во время получения снимка.
Рис. 6. Преимущества использования систем автофокусировки при получении изображений в заданный временной интервал
Рисунок 6 демонстрирует преимущества системы автоматической фокусировки на примере получения последовательности изображений в ходе длительного эксперимента, со съемкой в заданные моменты времени. Каждый из кадров последовательности представляет интервал в 4 часа. Образец — клетки фибробласта легкого серой лисицы (линия FoLu), стабильно трансфецированные beta-актином человека, слитым с флуоресцентным белком mCherry. Флуоресцентно окрашенный актин концентрируется в стрессорных волокнах цитоскелета. Видно, что клетка на рисунках 6(a) — 6(d) медленно выходит (дрейфует) из фокуса вследствие температурных флуктуаций, возникающих в течение 16-часовой последовательности в режиме съемки в заданные моменты времени. Яркие и четко видные стрессорные волокна (рисунок 6(a)) по мере дрейфа фокусировки становятся менее определенными (рисунок 6(b)), пока не остаются различимыми только окрашенный актин в цитоплазматических волнах (раффлах) и цитозольный пул (рисунки 6© и 6(d)). Напротив, с использованием автоматической фокусировки видно, как диспергируют «резкие» стрессорные волокна (рисунок 6(e)) при вхождении центральной клетки поля зрения в метафазу (рисунок 6(f)), но снова появляются, когда дочерние клетки присоединяются к покровному стеклу и растекаются по нему (рисунки 6(g) и 6(h)).
Образец — клетки фибробласта легкого серой лисицы (линия FoLu), стабильно трансфецированные beta-актином человека, слитым с флуоресцентным белком mCherry. Флуоресцентно окрашенный актин концентрируется в стрессорных волокнах цитоскелета. Видно, что клетка на рисунках 6(a) — 6(d) медленно выходит (дрейфует) из фокуса вследствие температурных флуктуаций, возникающих в течение 16-часовой последовательности в режиме съемки в заданные моменты времени. Яркие и четко видные стрессорные волокна (рисунок 6(a)) по мере дрейфа фокусировки становятся менее определенными (рисунок 6(b)), пока не остаются различимыми только окрашенный актин в цитоплазматических волнах (раффлах) и цитозольный пул (рисунки 6© и 6(d)). Напротив, с использованием автоматической фокусировки видно, как диспергируют «резкие» стрессорные волокна (рисунок 6(e)) при вхождении центральной клетки поля зрения в метафазу (рисунок 6(f)), но снова появляются, когда дочерние клетки присоединяются к покровному стеклу и растекаются по нему (рисунки 6(g) и 6(h)). Сохранение фокусировки, в процессе сбора протяженных по времени последовательностей изображений, часто является главным фактором успеха эксперимента
Сохранение фокусировки, в процессе сбора протяженных по времени последовательностей изображений, часто является главным фактором успеха эксперимента
Одним из заключительных аспектов оценки систем автофокусировки является суммарное время, в течение которого необходимо получать изображения; это могут быть секунды, часы и даже дни. В ходе длительных экспериментов, работе систем с непрерывным контролем (с постоянно работающей обратной связью) может препятствовать механический дрейф, вызванный гистерезисом, или «сползание», возникающее из-за помех в пьезоэлектрических приводах. Для краткосрочных исследований эти проблемы несущественны, но могут стать весьма серьезными при долгосрочном получении изображений. Обе вышеупомянутые проблемы могут осложняться при использовании объективов с высокой числовой апертурой (и увеличением), малая глубина фокусировки (резкости) которых требует строгого контроля и высокой точности. Независимо от возможных помех, создаваемых системами автоматической фокусировки, они вносят неоценимый вклад во флуоресцентную высокоразрешающую микроскопию живых клеток.
Источники освещения для получения изображений живых клеток
Традиционно в осветительных системах для широкопольной микроскопии в качестве источников освещения используются галогенные лампы с вольфрамовой нитью накаливания (для режима проходящего света) и газоразрядные лампы с короткой дугой (для возбуждения флуоресценции). Что касается лазеров, то в качестве источников для широкопольных микроскопов они используются весьма ограниченно. Однако, широкое распространение конфокальных и многофотонных микроскопов значительно повысило степень использования лазеров в оптической микроскопии. Поскольку, едва ли не одним из самых важных параметров для получения данных при визуализации живых клеток является отношение «сигнал/шум», камеру для образца необходимо освещать с высокой интенсивностью, чтобы достичь максимального уровня сигнала и полного разрешения оптической системы.
Однако, будучи сфокусированной на полной мощности через объектив со 100-кратным увеличением и числовой апертурой 1,4, 100-ваттная ртутная дуговая лампа, всего лишь за несколько секунд наносит серьезный ущерб жизнеспособности клеток млекопитающих. Аналогичные повреждения, только медленнее, получают клетки млекопитающих, когда на полной мощности освещаются вольфрамово-галогенной или ксеноновой лампой. А лазер высокой мощности может разрушить такие клетки даже быстрее, чем ртутная лампа. Следовательно, интенсивность и спектральный состав света, воздействующего на образец, необходимо тщательно регулировать. В экспериментах по визуализации живых клеток следует использовать только ограниченные, действительно необходимые для исследования, области спектра (для освещения флуорофора, фотоактивации, фотообесцвечивания и т. д.). Практически во всех ситуациях, ограничения уровней освещения и диапазонов излучения представляют собой компромисс между качеством изображения и поддержанием жизнеспособности клеток.
Аналогичные повреждения, только медленнее, получают клетки млекопитающих, когда на полной мощности освещаются вольфрамово-галогенной или ксеноновой лампой. А лазер высокой мощности может разрушить такие клетки даже быстрее, чем ртутная лампа. Следовательно, интенсивность и спектральный состав света, воздействующего на образец, необходимо тщательно регулировать. В экспериментах по визуализации живых клеток следует использовать только ограниченные, действительно необходимые для исследования, области спектра (для освещения флуорофора, фотоактивации, фотообесцвечивания и т. д.). Практически во всех ситуациях, ограничения уровней освещения и диапазонов излучения представляют собой компромисс между качеством изображения и поддержанием жизнеспособности клеток.
Один из наилучших критериев для определения чрезмерно высокой интенсивности освещения состоит в том, входят ли клетки в условиях эксперимента в фазу митоза и завершают ли его. Некоторые клетки, например, эмбриональные, относительно устойчивы к видимому свету, возможно, потому, что у них отсутствует остановка цикла деления как реакция на повреждение ДНК. Однако, многие из наиболее популярных линий клеток млекопитающих, включая клетки кенгуровой крысы, почки свиньи и индийского мунтжака, а также наиболее популярные культуры, чрезвычайно чувствительны к свету. Независимо от используемого для эксперимента источника света, в оптическую систему необходимо устанавливать светофильтры, чтобы предотвратить наличие в освещении даже ничтожных количеств ультрафиолетового и инфракрасного излучения.
Однако, многие из наиболее популярных линий клеток млекопитающих, включая клетки кенгуровой крысы, почки свиньи и индийского мунтжака, а также наиболее популярные культуры, чрезвычайно чувствительны к свету. Независимо от используемого для эксперимента источника света, в оптическую систему необходимо устанавливать светофильтры, чтобы предотвратить наличие в освещении даже ничтожных количеств ультрафиолетового и инфракрасного излучения.
Несмотря на то, что широко использующиеся для получения флуоресцентных изображений современные полосовые фильтры обладают высокими уровнями блокировки в видимой части спектра, им все же свойственно пропускать некоторые количества самых коротковолновых и длинноволновых излучений. Поэтому, целесообразно установить на пути лучей недорогие стеклянные фильтры, чтобы блокировать излучение по краям спектрального диапазона видимого света. Такие дополнительные фильтры особенно важны при использовании ртутных дуговых ламп, поскольку последние создают очень высокие уровни ультрафиолетового излучения. Вольфрамово-галогенные лампы излучают большие количества инфракрасных волн, вследствие чего требуют применения инфракрасных фильтров во всех экспериментах с живыми клетками. Ксеноновые лампы, напротив, излучают намного меньше ультрафиолета, но имеют пики излучения в ближней инфракрасной области. Набирающие популярность металлогалоидные лампы формируют спектр, аналогичный спектру ртутной лампы, но с большей интенсивностью в длинноволновой части.
Вольфрамово-галогенные лампы излучают большие количества инфракрасных волн, вследствие чего требуют применения инфракрасных фильтров во всех экспериментах с живыми клетками. Ксеноновые лампы, напротив, излучают намного меньше ультрафиолета, но имеют пики излучения в ближней инфракрасной области. Набирающие популярность металлогалоидные лампы формируют спектр, аналогичный спектру ртутной лампы, но с большей интенсивностью в длинноволновой части.
Рис. 7. Спектральные характеристики распространенных источников света
На рисунке 7 представлены спектральные профили некоторых источников освещения, широко использующихся для визуализации живых клеток. Отдельные пики в спектрах излучения ртутных и металлогалоидных ламп рассматриваются ниже. Вольфрамово-галогенная лампа сравнительно мало излучает в ультрафиолетовой области спектра, но интенсивность ее излучения постепенно возрастает, прежде чем установиться практически на постоянном уровне в ближней инфракрасной области. В центре видимого диапазона (550 нанометров) выходная мощность лампы накаливания составляет около 25% от выходной мощности ртутной дуговой лампы. В отличие от ртутной, ксеноновая дуговая лампа обладает низкой выходной мощностью в видимой части спектра, — основная часть ее энергии приходится на излучение с длиной волны более 800 нм. Однако, в видимой части спектра профиль выходной мощности излучения ксеноновой лампы намного более плавный, чем у ртутной и металлогалоидной ламп. Все, представленные на рисунке 7, источники света находят широкое применение в сфере визуализации живых клеток.
В центре видимого диапазона (550 нанометров) выходная мощность лампы накаливания составляет около 25% от выходной мощности ртутной дуговой лампы. В отличие от ртутной, ксеноновая дуговая лампа обладает низкой выходной мощностью в видимой части спектра, — основная часть ее энергии приходится на излучение с длиной волны более 800 нм. Однако, в видимой части спектра профиль выходной мощности излучения ксеноновой лампы намного более плавный, чем у ртутной и металлогалоидной ламп. Все, представленные на рисунке 7, источники света находят широкое применение в сфере визуализации живых клеток.
Наиболее распространенным источником освещения для визуализации клеток с использованием методов улучшения контрастности в режиме светлого поля (преимущественно, ДИК, HMC и фазового контраста), является 100-ваттная галогенная лампа с вольфрамовой нитью накаливания (вольфрамово-галогенная лампа). Во время длительных экспериментов в нормальных условиях эксплуатации эта лампа особенно стабильна, и подвержена только незначительным флуктуациям интенсивности (пространственным и временным). С целью повышения временнóй стабильности для проведения экспериментов с получением изображений в заданные интервалы времени, когда в течение длительного периода времени делаются сотни или даже тысячи снимков, систему можно оборудовать стабилизированным источником электропитания. Как правило, такая мера требуется только для лабораторных условий, где нередки падения сетевого напряжения. Использование зеленого или красного светофильтра для блокировки ультрафиолетовой и синей составляющих спектра в режимах светлопольного получения изображений, с целью сохранения жизнеспособности клеток, снижает суммарную интенсивность освещения. Во многих случаях, для дифференциально-интерференционного и фазового контраста используется зеленый интерференционный светофильтр на длину волны 546 нм, но более длинноволновые фильтры работают, как правило, так же хорошо. Следует отметить, что с современными флюоритовыми и апохроматическими объективами больше не нужно использовать зеленый интерференционный светофильтр для классической коррекции хроматической аберрации при получении изображений в режимах светлого поля.
С целью повышения временнóй стабильности для проведения экспериментов с получением изображений в заданные интервалы времени, когда в течение длительного периода времени делаются сотни или даже тысячи снимков, систему можно оборудовать стабилизированным источником электропитания. Как правило, такая мера требуется только для лабораторных условий, где нередки падения сетевого напряжения. Использование зеленого или красного светофильтра для блокировки ультрафиолетовой и синей составляющих спектра в режимах светлопольного получения изображений, с целью сохранения жизнеспособности клеток, снижает суммарную интенсивность освещения. Во многих случаях, для дифференциально-интерференционного и фазового контраста используется зеленый интерференционный светофильтр на длину волны 546 нм, но более длинноволновые фильтры работают, как правило, так же хорошо. Следует отметить, что с современными флюоритовыми и апохроматическими объективами больше не нужно использовать зеленый интерференционный светофильтр для классической коррекции хроматической аберрации при получении изображений в режимах светлого поля.
Вообще говоря, при визуализации в режиме светлого поля следует выбирать тот диапазон излучения источника освещения, который менее всего вреден для образца. В результате обширных исследований выявлено, что в большинстве своем, клетки обладают слабой устойчивостью к ультрафиолетовому и инфракрасному излучению, и менее всего чувствительны к красному, зеленому и синему свету (в порядке возрастания чувствительности). Таким образом, с биологической точки зрения целесообразно, где это возможно, использовать для исследований живых клеток красный свет (с длиной волны 600 — 650 нм), несмотря на то, что с увеличением длины волны ухудшается разрешение, а некоторые ПЗС-камеры менее чувствительны к излучению из этого диапазона. Разрешающая способность менее важна, нежели жизнеспособность клеток, да и ограничивается разрешение, в большей степени, внутриклеточными движениями, дрейфом температуры и дефектами оптической и осветительной систем. Ограничения чувствительности фотокамер быстро стали объектом пристального внимания производителей, которые стараются создавать изделия с более равномерной чувствительностью во всей видимой области спектра.
Плазменные источники с короткой дугой обладают наибольшей яркостью и интенсивностью излучения из всех непрерывно работающих источников света, и очень близки к модели идеального точечного источника света. Однако, дуговым лампам свойственны значительно бóльшие флуктуации интенсивности, чем лампам накаливания (вольфрамово-галогенным), в силу того, что газоразрядная плазма по своей природе неустойчива и подвержена влиянию магнитных полей и эрозии электродов. Главное влияние на кратковременную стабильность оказывают три артефакта дуги, создаваемые между вольфрамовыми электродами. Мерцание дуги возникает тогда, когда точка соединения дуги с коническим кончиком катода кругообразно перемещается по поверхности электрода; полный круг дуга описывает, обычно, за несколько секунд. Вспышка — этим термином обозначается мгновенное изменение яркости в результате перемещения дуги в новое место на катоде, обладающее бóльшим эмиссионным качеством, чем предшествующая точка присоединения дуги. Конвекционные потоки в газообразном ксеноне или в парах ртути, обусловленные разностью температур между дугой и баллоном создают флаттер (пульсирующие колебания) дуги, проявляющийся в виде быстрого поперечного смещения ее столба. Металлогалоидные дуговые лампы, помимо ртути, содержат галогены, в частности, йод и бром, и работают по принципу, известному как вольфрамово/галлоидный цикл, когда галогены препятствуют оседанию на стенках баллона испаряющегося с электродов вольфрама, и тем самым, продлевают срок службы и повышают устойчивость работы лампы. Сегодня эти источники света находятся среди наиболее предпочитаемых во флуоресцентной микроскопии.
Конвекционные потоки в газообразном ксеноне или в парах ртути, обусловленные разностью температур между дугой и баллоном создают флаттер (пульсирующие колебания) дуги, проявляющийся в виде быстрого поперечного смещения ее столба. Металлогалоидные дуговые лампы, помимо ртути, содержат галогены, в частности, йод и бром, и работают по принципу, известному как вольфрамово/галлоидный цикл, когда галогены препятствуют оседанию на стенках баллона испаряющегося с электродов вольфрама, и тем самым, продлевают срок службы и повышают устойчивость работы лампы. Сегодня эти источники света находятся среди наиболее предпочитаемых во флуоресцентной микроскопии.
Рис. 8. Высококачественные осветители для визуализации живых клеток
Только 45% излучения стандартной ртутной лампы (HBO; 100 ватт) приходятся на пригодный для флуоресцентной микроскопии диапазон (от 350 до 700 нанометров). Более того, бóльшая часть энергии излучения такой лампы сконцентрирована в отдельных спектральных линиях: 366 нм (10,7%), 436 нм (12,6%), 546 нм (7,1%) и 579 нм (7,9%). Хотя в диапазоне 350 — 700 нм полезная выходная мощность ксеноновой лампы (XBO; 75 ватт) распределяется сравнительно равномерно, но составляет всего лишь 24,5% от общей излучаемой мощности, а бóльшая часть энергии (приблизительно, 74%) приходится на ближний инфракрасный диапазон. Ксеноновые дуговые лампы часто используются в тех случаях, когда требуется широкий диапазон возбуждающего излучения. По спектральному распределению выходной мощности излучение ксеноновой лампы аналогично солнечному свету, поскольку обеспечивает равномерную интенсивность, без заметных пиков, в видимом и ультрафиолетовом диапазонах.
Хотя в диапазоне 350 — 700 нм полезная выходная мощность ксеноновой лампы (XBO; 75 ватт) распределяется сравнительно равномерно, но составляет всего лишь 24,5% от общей излучаемой мощности, а бóльшая часть энергии (приблизительно, 74%) приходится на ближний инфракрасный диапазон. Ксеноновые дуговые лампы часто используются в тех случаях, когда требуется широкий диапазон возбуждающего излучения. По спектральному распределению выходной мощности излучение ксеноновой лампы аналогично солнечному свету, поскольку обеспечивает равномерную интенсивность, без заметных пиков, в видимом и ультрафиолетовом диапазонах.
На рисунке 8 представлены некоторые, наиболее совершенные из имеющихся сегодня в продаже источников освещения для визуализации живых клеток. Металлогалоидная лампа (рисунок 8(a)) быстро становится одним из самых распространенных источников освещения для широкопольной микроскопии, и часто используется для замены ртутной дуговой лампы. Внешние ксеноновые осветители (рисунки 8(b) и 8©) обычно соединяются с коллиматором (установленным во входном порту микроскопа) одномодовым волоконным или жидкостным световодом. Наиболее универсальным источником освещения является монохроматор (рисунок 8(d)). Он позволяет выбирать конкретную длину волны возбуждающего излучения, но является, также, и самым дорогим вариантом. Как правило, в монохроматоре используется ксеноновая, или аналогичная дуговая лампа. Конструкция монохроматора, за счет смены светофильтров освещения и возбуждающего излучения, позволяет чрезвычайно быстро выбирать длину волны для флуоресцентной микроскопии. В совокупности, представленные на рисунке 8 источники освещения, предоставляют пользователю широкий диапазон выбора, соответствующий любому бюджету.
Наиболее универсальным источником освещения является монохроматор (рисунок 8(d)). Он позволяет выбирать конкретную длину волны возбуждающего излучения, но является, также, и самым дорогим вариантом. Как правило, в монохроматоре используется ксеноновая, или аналогичная дуговая лампа. Конструкция монохроматора, за счет смены светофильтров освещения и возбуждающего излучения, позволяет чрезвычайно быстро выбирать длину волны для флуоресцентной микроскопии. В совокупности, представленные на рисунке 8 источники освещения, предоставляют пользователю широкий диапазон выбора, соответствующий любому бюджету.
Много усилий было затрачено на синтез флуорофоров, имеющих максимумы поглощения вблизи пиковых спектральных линий излучения ртути. Например, классические зонды — родамин и MitoTracker Red, с высокой эффективностью поглощают излучение с длиной волны, соответственно, 546 нм и 579 нм (одни из пиковых линий спектра излучения ртути), а максимумы поглощения серии красителей Alexa Fluor соответствуют большинству пиков спектра излучения ртути (350 нм, 405 нм, 440 нм, 546 нм и 568 нм). На протяжении многих лет дуговые ртутные лампы были самыми распространенными источниками света для флуоресцентной микроскопии. Но, как уже упоминалось, они не обеспечивают равномерное поле освещения и демонстрируют сильные кратковременные флуктуации выходной мощности. Оба этих недостатка могут создавать серьезные проблемы для количественного анализа флуоресценции. Спектр излучения металлогалоидных ламп похож на спектр излучения ртутных ламп HBO, но, помимо этого, имеет, примерно, на 50% более мощные непиковые интенсивности. Поэтому, те флуорофоры, которые не демонстрируют заметное возбуждение спектром излучения ртутной лампы, например, флуоресцеин и Alexa Fluor 488, при освещении металлогалоидными источниками дают более яркие изображения. Кроме того, плотность потока излучения металлогалоидных ламп намного более равномерна, что очень легко обнаруживается при использовании цифровых камер. Ксеноновые лампы, хотя и менее ярки, также более стабильны, чем ртутные, и обеспечивают практически постоянную освещенность для флуорофоров во всем видимом диапазоне спектра.
На протяжении многих лет дуговые ртутные лампы были самыми распространенными источниками света для флуоресцентной микроскопии. Но, как уже упоминалось, они не обеспечивают равномерное поле освещения и демонстрируют сильные кратковременные флуктуации выходной мощности. Оба этих недостатка могут создавать серьезные проблемы для количественного анализа флуоресценции. Спектр излучения металлогалоидных ламп похож на спектр излучения ртутных ламп HBO, но, помимо этого, имеет, примерно, на 50% более мощные непиковые интенсивности. Поэтому, те флуорофоры, которые не демонстрируют заметное возбуждение спектром излучения ртутной лампы, например, флуоресцеин и Alexa Fluor 488, при освещении металлогалоидными источниками дают более яркие изображения. Кроме того, плотность потока излучения металлогалоидных ламп намного более равномерна, что очень легко обнаруживается при использовании цифровых камер. Ксеноновые лампы, хотя и менее ярки, также более стабильны, чем ртутные, и обеспечивают практически постоянную освещенность для флуорофоров во всем видимом диапазоне спектра. Для решения проблемы неоднородной освещенности при использовании дуговых ламп, можно соединить блок осветителя со входным портом микроскопа, уже упоминавшимся жидкостным световодом. За счет рассеяния проходящего через него света, световод создает более равномерное световое поле. Флуктуации выходной мощности во времени более трудно контролировать; наиболее успешными являются механизмы с использованием обратной связи, контролирующие параметры электропитания (потребляемую мощность) лампы.
Для решения проблемы неоднородной освещенности при использовании дуговых ламп, можно соединить блок осветителя со входным портом микроскопа, уже упоминавшимся жидкостным световодом. За счет рассеяния проходящего через него света, световод создает более равномерное световое поле. Флуктуации выходной мощности во времени более трудно контролировать; наиболее успешными являются механизмы с использованием обратной связи, контролирующие параметры электропитания (потребляемую мощность) лампы.
Как правило, микроскопы, использующиеся для визуализации живых клеток в проходящем и флуоресцентном свете работают в режиме освещения по схеме Келера. Эта универсальная схема предназначена для равномерного освещения поля изображения специальным пространственно- комплексным источником (дуговыми или вольфрамово-галогенными лампами), за счет изображения только части источника в фокальной плоскости конденсора — в режиме проходящего света, или же в задней фокальной плоскости объектива — в режиме флуоресценции с эпископическим освещением. Падающий на источник свет равномерен, хотя и не может поступать с одинаковым распределением при различных возможных углах падения. Полевая диафрагма (которая, фактически, лежит в промежуточной плоскости изображения) проецируется на образец, с целью ограничить освещаемую область без изменения угла падения освещающего излучения. Для усиления однородности освещения в фокальной плоскости, в случае очень неоднородных источников можно использовать диффузионный фильтр. Схема освещения по Келеру не является самой эффективной, поскольку не использует всю поверхность источника и полное угловое распределение излучаемого света. Однако, для микроскопов, оборудованных только таким осветителем, который излучает свет непосредственно в конденсор, освещение по Келеру остается наилучшим вариантом юстировки микроскопа.
Падающий на источник свет равномерен, хотя и не может поступать с одинаковым распределением при различных возможных углах падения. Полевая диафрагма (которая, фактически, лежит в промежуточной плоскости изображения) проецируется на образец, с целью ограничить освещаемую область без изменения угла падения освещающего излучения. Для усиления однородности освещения в фокальной плоскости, в случае очень неоднородных источников можно использовать диффузионный фильтр. Схема освещения по Келеру не является самой эффективной, поскольку не использует всю поверхность источника и полное угловое распределение излучаемого света. Однако, для микроскопов, оборудованных только таким осветителем, который излучает свет непосредственно в конденсор, освещение по Келеру остается наилучшим вариантом юстировки микроскопа.
Помимо того, что метод освещения по Келеру предназначен для обеспечения равномерного освещения и контроля его когерентности, использование световода дает возможность достичь однородности освещения. Преобразование света, эффективно снижающее его когерентность в пространстве или во времени, также достигается за счет применения световодов. Наиболее широко использующийся и практичный метод подсоединения источника света к микроскопу, одновременно снижающий когерентность, состоит в сфокусированном направлении света в одномодовое оптоволокно или в жидкостный световод (см. рисунок 9). Тепловое движение в жидкостном световоде непрерывно изменяет оптический путь пучка и рассеивает его, эффективно устраняя пространственную и временную когерентность. Поскольку волокно слегка изгибается, векторы отражения от оболочки спирального одномодового оптоволокна непрерывно изменяются, формируя выходной пучок, фактически однородный по интенсивности во времени и в пространстве. Кроме того, эффективно скремблирует свет вибрация оптоволокна (с частотой до 100 килогерц). Скремблирование фазы светового излучения происходит за счет различных длин оптических путей, по которым световые волны проходят через оптоволокно, хотя высокая интенсивность и монохроматичность, при этом, сохраняются.
Преобразование света, эффективно снижающее его когерентность в пространстве или во времени, также достигается за счет применения световодов. Наиболее широко использующийся и практичный метод подсоединения источника света к микроскопу, одновременно снижающий когерентность, состоит в сфокусированном направлении света в одномодовое оптоволокно или в жидкостный световод (см. рисунок 9). Тепловое движение в жидкостном световоде непрерывно изменяет оптический путь пучка и рассеивает его, эффективно устраняя пространственную и временную когерентность. Поскольку волокно слегка изгибается, векторы отражения от оболочки спирального одномодового оптоволокна непрерывно изменяются, формируя выходной пучок, фактически однородный по интенсивности во времени и в пространстве. Кроме того, эффективно скремблирует свет вибрация оптоволокна (с частотой до 100 килогерц). Скремблирование фазы светового излучения происходит за счет различных длин оптических путей, по которым световые волны проходят через оптоволокно, хотя высокая интенсивность и монохроматичность, при этом, сохраняются. Выходной пучок имеет скорее цилиндрический, а не гауссов профиль распределения интенсивности, характерный для лазерного излучения. Во избежание теплового повреждения оптического преобразователя, следует удалить из светового пучка инфракрасную, а также другие нежелательные составляющие, прежде, чем они попадут в оптоволоконный или жидкостный световод. В идеальном случае, из источника освещения должны выходить только те спектральные составляющие, которые важны для формирования изображения (кривые пропускания оптоволоконного и жидкостного световодов представлены на рисунке 9). Для селекции световых волн, которые будут проходить к апертурному диску, и для отвода нежелательного тепла следует использовать не широкополосные, а холодные (отражающие видимое и пропускающие ИК-излучение) зеркала и полосовые интерференционные фильтры.
Выходной пучок имеет скорее цилиндрический, а не гауссов профиль распределения интенсивности, характерный для лазерного излучения. Во избежание теплового повреждения оптического преобразователя, следует удалить из светового пучка инфракрасную, а также другие нежелательные составляющие, прежде, чем они попадут в оптоволоконный или жидкостный световод. В идеальном случае, из источника освещения должны выходить только те спектральные составляющие, которые важны для формирования изображения (кривые пропускания оптоволоконного и жидкостного световодов представлены на рисунке 9). Для селекции световых волн, которые будут проходить к апертурному диску, и для отвода нежелательного тепла следует использовать не широкополосные, а холодные (отражающие видимое и пропускающие ИК-излучение) зеркала и полосовые интерференционные фильтры.
Рис. 9. Кривые пропускания оптоволоконного и жидкостного световодов
Критической проблемой использования жидкостных или волоконно-оптических световодов в микроскопии является эффективность подсоединения внешних осветителей. Числовая апертура большинства оптических волокон лежит в диапазоне 0,2 — 0,55, и это значение необходимо согласовать с оптикой, собирающей излучение источника. Некоторые производители выпускают осветители, предназначенные для работы с жидкостными световодами, в которых это условие соблюдено. Сочетание 75-ваттной ксеноновой лампы в эллиптическом рефлекторе, холодного зеркала и оптически согласованного жидкостного световода, диаметром 3 — 5 миллиметров, может обеспечить световой выход более 2 милливатт на нанометр. Независимо от размера дуги лампы, конец световода становится эффективным источником света для микроскопа, с меньшей, чем у собственно дуги, интенсивностью. Однако, когда цель состоит в равномерном освещении апертуры большого диаметра, как в случае конфокального микроскопа с вращающимся диском, протяженный источник не столь вреден для характеристик системы. Единственное требование заключается в наличии коллимирующей линзы с диаметром, достаточным для того, чтобы эффективно собрать световой поток на выходе световода и спроецировать его на дисковый сканер.
Числовая апертура большинства оптических волокон лежит в диапазоне 0,2 — 0,55, и это значение необходимо согласовать с оптикой, собирающей излучение источника. Некоторые производители выпускают осветители, предназначенные для работы с жидкостными световодами, в которых это условие соблюдено. Сочетание 75-ваттной ксеноновой лампы в эллиптическом рефлекторе, холодного зеркала и оптически согласованного жидкостного световода, диаметром 3 — 5 миллиметров, может обеспечить световой выход более 2 милливатт на нанометр. Независимо от размера дуги лампы, конец световода становится эффективным источником света для микроскопа, с меньшей, чем у собственно дуги, интенсивностью. Однако, когда цель состоит в равномерном освещении апертуры большого диаметра, как в случае конфокального микроскопа с вращающимся диском, протяженный источник не столь вреден для характеристик системы. Единственное требование заключается в наличии коллимирующей линзы с диаметром, достаточным для того, чтобы эффективно собрать световой поток на выходе световода и спроецировать его на дисковый сканер.
В конфокальной микроскопии с вращающимися дисками используется такой механизм сканирования, при котором освещение заполняет заднюю апертуру объектива. Передача всего излучаемого источником света на образец представляет собой некий случай, более характерный для не лазерных систем, поскольку излучение таких источников, как дуговые лампы, представляет, скорее, сферу, а не параллельный пучок. Следовательно, чтобы направить на образец свет от тыльной стороны дуги, необходим рефлектор. Ненужные составляющие спектра, например, ультрафиолет и ИК-излучение, можно пропустить через дихроичные зеркала (инфракрасный излучатель обозначается термином холодное зеркало, а ультрафиолетовый — горячее зеркало), — они будут поглощены в блоке осветителя. Рассеяние тепла холодным зеркалом уменьшает перемещение источника, вызванное тепловым расширением механических и оптических компонентов. В микроскопии всех типов линзы, находящиеся вблизи источников тепла, необходимо устанавливать с учетом теплового расширения. Рынок вспомогательного оборудования предлагает широкий выбор осветителей, в которых внешний источник света (обычно, ксеноновый или металлогалоидный) соединяется с микроскопом волоконно-оптическим или жидкостным световодом (см. рисунок 8). Кроме того, для прецизионной частотной селекции предлагаются специальные монохроматоры. Несмотря на высокую стоимость, эти устройства превосходно подходят для количественной микроскопии. К окончательному выбору источника освещения и спектрального диапазона для визуализации живых клеток необходимо подходить с учетом того факта, что высокоинтенсивный свет любого спектрального состава по своей природе вреден для живых клеток. Независимо от того, оптимизирован спектральный диапазон, или нет, источник света все время, за исключением непосредственно момента съемки, должен быть закрыт затвором.
Рынок вспомогательного оборудования предлагает широкий выбор осветителей, в которых внешний источник света (обычно, ксеноновый или металлогалоидный) соединяется с микроскопом волоконно-оптическим или жидкостным световодом (см. рисунок 8). Кроме того, для прецизионной частотной селекции предлагаются специальные монохроматоры. Несмотря на высокую стоимость, эти устройства превосходно подходят для количественной микроскопии. К окончательному выбору источника освещения и спектрального диапазона для визуализации живых клеток необходимо подходить с учетом того факта, что высокоинтенсивный свет любого спектрального состава по своей природе вреден для живых клеток. Независимо от того, оптимизирован спектральный диапазон, или нет, источник света все время, за исключением непосредственно момента съемки, должен быть закрыт затвором.
Заключение
На этапе настройки конфигурации микроскопической оптической системы для визуализации живых клеток, важнейший аспект, зачастую, заключается в необходимости компромисса между поддержанием жизнеспособности клеток и достижением наилучшего временного и пространственного разрешения. Конструкции большинства коммерческих микроскопов разработаны с целью получения изображений максимального качества, но не обязательно для поддержания клеточных культур в здоровом состоянии. Тем не менее, при тщательном планировании, стандартный серийный микроскоп можно легко модифицировать в настоящую систему для визуализации живых клеток. Особое внимание следует уделить камерам для образцов, дрейфу фокусировки, цифровым фотокамерам, источникам освещения, затворам, комбинациям фильтров и компенсации вибраций. Описанные в настоящем обзоре концепции доказали свою практичность и эффективность в результате целого ряда исследований.
Конструкции большинства коммерческих микроскопов разработаны с целью получения изображений максимального качества, но не обязательно для поддержания клеточных культур в здоровом состоянии. Тем не менее, при тщательном планировании, стандартный серийный микроскоп можно легко модифицировать в настоящую систему для визуализации живых клеток. Особое внимание следует уделить камерам для образцов, дрейфу фокусировки, цифровым фотокамерам, источникам освещения, затворам, комбинациям фильтров и компенсации вибраций. Описанные в настоящем обзоре концепции доказали свою практичность и эффективность в результате целого ряда исследований.
Световая микроскопия, световой микроскоп — Справочник химика 21
Наряду с изучением рассеяния света дисперсной системой в целом применяются также методы, основанные на регистрации рассеяния (дифракции) света на единичных частицах. Этот метод — ультрамикроскопия — имел большое значение в развитии коллоидной химии. Для наблюдения рассеяния света отдельными частицами применяются оптические системы с темным полем. К их числу относятся ультрамикроскопы, в которых интенсивный сфокусированный световой поток направляется сбоку на исследуемую систему, а также конденсоры темного поля, которые используются в обычных микроскопах для создания бокового освещения. Регистрация светящихся точек, хорошо видимых на темном фоне и представляющих собой свет, рассеянный (дифрагированный) отдельными частицами, позволяет определить концентрацию частиц дисперсной фазы, наблюдать флуктуации их концентрации и броуновское движение. Такие опыты, проведенные Перреном, Сведбергом и рядом других ученых, явились подтверждением правильности теории броуновского движения (см. гл. V) и молекулярно-кинетической концепции в целом. С. И. Вавиловым был разработан иной метод изучения броуновского движения. В этом методе производилась фотосъемка частиц дисперсной фазы, находящихся в броуновском движении. Перемещение частиц приводило к тому, что их изображения на пластинках имели вид размазанных пятен в полном согласии с теорией броуновского движения средняя площадь этих пятен оказалась пропорциональной времени экспозиции.
Для наблюдения рассеяния света отдельными частицами применяются оптические системы с темным полем. К их числу относятся ультрамикроскопы, в которых интенсивный сфокусированный световой поток направляется сбоку на исследуемую систему, а также конденсоры темного поля, которые используются в обычных микроскопах для создания бокового освещения. Регистрация светящихся точек, хорошо видимых на темном фоне и представляющих собой свет, рассеянный (дифрагированный) отдельными частицами, позволяет определить концентрацию частиц дисперсной фазы, наблюдать флуктуации их концентрации и броуновское движение. Такие опыты, проведенные Перреном, Сведбергом и рядом других ученых, явились подтверждением правильности теории броуновского движения (см. гл. V) и молекулярно-кинетической концепции в целом. С. И. Вавиловым был разработан иной метод изучения броуновского движения. В этом методе производилась фотосъемка частиц дисперсной фазы, находящихся в броуновском движении. Перемещение частиц приводило к тому, что их изображения на пластинках имели вид размазанных пятен в полном согласии с теорией броуновского движения средняя площадь этих пятен оказалась пропорциональной времени экспозиции. В этом методе удается фиксировать одновременно несколько частиц, что облегчает получение необходимого для статистического усреднения большого количества экспериментальных результатов. [c.171]
В этом методе удается фиксировать одновременно несколько частиц, что облегчает получение необходимого для статистического усреднения большого количества экспериментальных результатов. [c.171] Принципиальная схема светового микроскопа представлена на рис. V. 1 а. Обычный микроскоп представляет собой двухступенчатый оптический увеличитель. В нем имеется система линз, называемая объективом 4, которая проектирует увеличенное изображение объекта S. Это промежуточное изображение 5 увеличивается другой системой линз — окуляром 6, через который ведет наблюдение исследователь. Объектив и окуляр помещены в тубусе микроскопа на одной оптической осн. Для устранения нежелательных дифракционных эффектов и обеспечения должной разрешающей способности предназначена система линз конденсора 2, благодаря которому пучок света от лампы / концентрируется в плоскости исследуемого объекта. Конечное изображение 7 регистрируется на фотопластинку 8.
 [c.248]
[c.248] В 1903 г. Р. Зигмонди и Г. Зидентопф предложили оптический метод изучения систем, содержащих частицы коллоидных размеров. По этому методу, называемому ультрамикроскопией, наблюдается свет, рассеянный одиночными частицами. Этот метод можно сравнить с наблюдением за движением отдельных пылинок, попавших в солнечный луч в темном помещении. Схема предложенного Зигмонди и Зидентопфом щелевого микроскопа показана на рис. 67. Свет от дуговой лампы фокусируется линзами в системе, частицы которой рассеивают свет. Чтобы выделить небольшое поле зрения под микроскопом, используется раздвижная щель, позволяющая вводить в изучаемый объект пучок света высотой в несколько микрометров. В ультрамикроскопе Зигмонди и Зидентопфа оптическая ось микроскопа перпендикулярна вводимому в объект лучу света. Э. Коттон и А. Мутон в 1903 г. сконструировали прибор, в котором направление светового луча и оптическая ось микроскопа совпадают. Для обеспечения темного фона в их приборе используется эффект полного внутреннего отражения.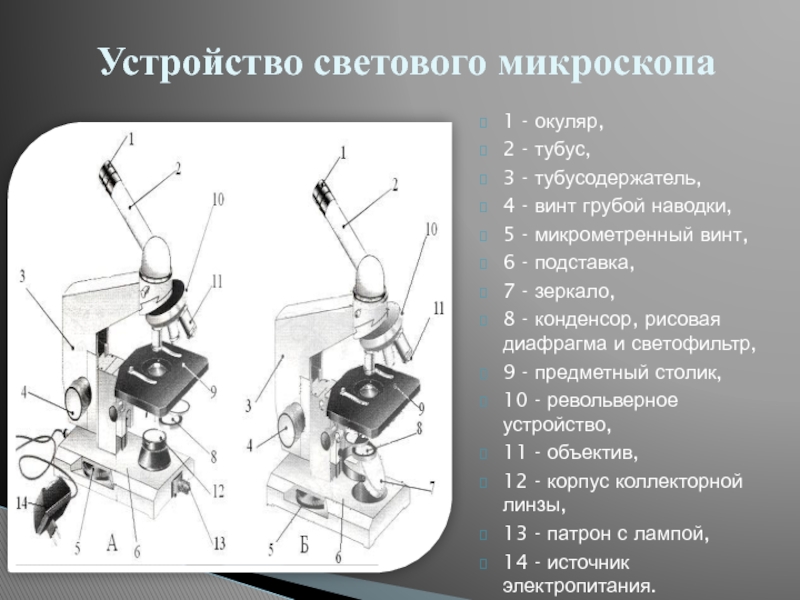 [c.162]
[c.162]
Несмотря на некоторую общность оптической схемы, условия формирования изображения в световом и электронном микроскопах принципиально различны. В световом микроскопе изображение получается, главным образом, вследствие различной поглощающей способности световых лучей отдельными элементами объекта. Многие препараты, особенно биологические, во всех своих частях одинаково прозрачны для видимого света, поэтому их наблюдение в микроскопе затруднено. Если предварительно избирательно окрасить объект, то он начинает поглощать больше света по сравнению с окружающим бесцветным фоном и становится ясно видимым. В электронном микроскопе объект не должен заметно поглощать электроны. Взаимодействие электронов с объектом должно носить характер упругих столкновений, т. е. энергия электронов при прохождении через объект не должна существенно изменяться. Формирование контраста изображения связано с разной степенью рассеивания электронов различными участками объекта. [c. 171]
171]
Методы световой микроскопии классифицируют по способам освещения объектов исследования. Освещение в проходящем свете применяется при рассмотрении деталей тонких объектов, которые должны быть илп окрашенными, или, если они не поглощают света, отличаться по показателю преломления от той среды, в которую помещены, хотя бы на 0,1. Для исследования многих объектов лучше применять микроскопию с использованием падающего света (в отраженном свете). Для исследования непрозрачных объектов 8T0 единственно возможный метод. Боковое освещение является [c.248]
Ультрамикроскоп не позволяет судить о форме и размерах коллоидных частиц, так как его разрешающая способность ограничена слишком большой для этого длиной волны видимого света. Для желаемой характеристики коллоидных частиц необходим прибор, работающий с более коротковолновыми лучами. Таким оказался электронный микроскоп, действие которого основано на использовании пучка электронов, получаемых в специальной катодной трубке и разгоняемых электрическим полем. Если длина волны светового луча, используемого в ультрамикроскопе, равна 500 нм, то длина волны электронного луча, используемого в электронном микроскопе, составляет 0,5 нм. В соответствии с этим, разрешающая способность электронного микроскопа в 1000 раз выше, чем у ультрамикроскопа. Это позволило глубоко проникнуть вглубь материи наблюдать отдельные группы молекул, исследовать структуру катализаторов, изучать строение молекул полимеров (например, белковых веществ) и т. д. [c.277]
Если длина волны светового луча, используемого в ультрамикроскопе, равна 500 нм, то длина волны электронного луча, используемого в электронном микроскопе, составляет 0,5 нм. В соответствии с этим, разрешающая способность электронного микроскопа в 1000 раз выше, чем у ультрамикроскопа. Это позволило глубоко проникнуть вглубь материи наблюдать отдельные группы молекул, исследовать структуру катализаторов, изучать строение молекул полимеров (например, белковых веществ) и т. д. [c.277]
Границы световой микроскопии определяются величиной ее разрешающей силы, равной 1/3 длины волны падающего излучения. В белом свете она лежит примерно при 200 нм. [c.155]
Теория показывает, что разрешающая способность микроскопа, т. е. то наименьшее расстояние, при котором две точки можно еще видеть отдельно друг от друга, составляет около половины длины световой волны. Таким образом, при использовании обычного света (длина волны 400—700 нм) в наилучший микроскоп видимы частицы, размер которых составляет не менее 0,2 мкм. При использовании ультрафиолетового света с помощью фотосъемки можно получить изображение более мелких частиц, но с диаметром все же не меньшим 0,1 мкм. Таким образом, коллоидные частицы лежат за пределами видимости в обычном микроскопе. [c.44]
При использовании ультрафиолетового света с помощью фотосъемки можно получить изображение более мелких частиц, но с диаметром все же не меньшим 0,1 мкм. Таким образом, коллоидные частицы лежат за пределами видимости в обычном микроскопе. [c.44]
Изучение рассеяния света важно для суждения о величине и форме частиц коллоидной дисперсности, которые слишком малы для непосредственного исследования их с помощью обычного микроскопа. На явлении рассеяния света основан ряд методов определения размера и формы частиц с использованием ультрамикроскопа, фотоэлектроколориметра, нефелометра и поляриметра. В ультрамикроскопе каждая частица обнаруживается в отдельности в виде светящейся точки или системы дифракционных колец. В остальных методах величина частицы оценивается на основании измерений интенсивности светового потока и степени поляризации в различных направлениях при рассеянии света в мутной среде. В совокупности эти методы дают возможность составить более или менее ясное представление и о форме частиц. [c.30]
[c.30]
Коллоидные растворы представляют собой ультрамикрогетерогенные системы обычно типа Т — Ж, т. е. твердое тело, раздробленное в жидкости. Размер коллоидных частиц лежит в пределах —100 нм, и именно в связи с такой высокой степенью дисперсности гетерогенность коллоидных растворов нельзя обнаружить с помощью обычного микроскопа. В связи с гетерогенностью коллоидные растворы рассеивают свет. Если наблюдать коллоидные растворы в проходящем свете, то они кажутся совершенно прозрачными. Но при боковом освещении они оставляют на пути прохождения пучка света на темном фоне световой след. Световые лучи рассеиваются коллоидным раствором во всех направлениях, и в частности попадают в [c.383]
Объективы современных световых микроскопов имеют апертурный угол, близкий к 90°. Следовательно, при показателе преломления, равном 1, и при использовании лучей видимого света, например сХ = 4500 А, разрешаемое расстояние составляет [c.167]
Иная картина в коллоидных системах. Размеры коллоидных частиц меньше длины волны падающего света. Световые лучи не могут отражаться от таких частиц, и поэтому коллоидные частицы невидимы даже в самые сильные оптические микроскопы. Светорассеяние в коллоидных системах вызвано явлением дифракции, которое заключается в том, что лучи света огибают коллоидные частицы и изменяют свое направление, рассеиваясь во все стороны. [c.36]
Размеры коллоидных частиц меньше длины волны падающего света. Световые лучи не могут отражаться от таких частиц, и поэтому коллоидные частицы невидимы даже в самые сильные оптические микроскопы. Светорассеяние в коллоидных системах вызвано явлением дифракции, которое заключается в том, что лучи света огибают коллоидные частицы и изменяют свое направление, рассеиваясь во все стороны. [c.36]
Ультрамикроскопия. Коллоидные частицы, имеющие диаметр меньше половины длины световой волны, не могут быть видимы в обычные микроскопы. Причина этого заключается в том, что световые волны огибают коллоидные частицы, а рассеиваемая часть света настолько мала, что не воспринимается глазом, тем более в условиях проходящего освещения. [c.127]
Эксперименты проводят по следующей схеме (см. рис. 29). В стенках трубы предварительно сделаны остекленные отверстия, что дает возможность пропускать сквозь покрытие пучок света с помощью зеркала, установленного на подставке в трубе. Сверху световой пучок воспринимается объективом поляризационного микроскопа, установленного непосредственно на трубе [c.91]
Сверху световой пучок воспринимается объективом поляризационного микроскопа, установленного непосредственно на трубе [c.91]
На рис. 72 показаны направление световой полосы и направление наблюдения профиля. Для наблюдений удобнее всего использовать микроскоп. Специальная аппаратура позволяет направить плоский тонкий пучок света наклонно по отношению к исследуемой поверхности и рассматривать линию профиля под определенным углом. При использовании специального объектива можно достаточно точно определять глубину коррозионных язвин и питтингов (в пределах [c.224]
Микроскопический метод исследования с помощью светового потока. Направляя луч монохроматического света через специальную линзу микроскопа на отражающую плоскую поверхность металла под углом 45°, с помощью другой линзы можно наблюдать отраженное изображение. При неровной поверхности световые лучи отклоняются на величину, пропорциональную высоте неровностей поверхности. Таким образом, если с небольшой площади поверхности полностью удалить металлическое покрытие и направить на этот участок луч света, то отклонение луча даст абсолютную величину толщины покрытия. В случае прозрачных покрытий, т. е. неметаллических (таких, как чистые оксидные покрытия, образуемые анодным окислением алюминия), получают отражение от поверхности как покрытия, так и основного металла, без снятия покрытия. Данный метод не приводит к нарушению покрытия. [c.140]
В случае прозрачных покрытий, т. е. неметаллических (таких, как чистые оксидные покрытия, образуемые анодным окислением алюминия), получают отражение от поверхности как покрытия, так и основного металла, без снятия покрытия. Данный метод не приводит к нарушению покрытия. [c.140]
Интерферометрический метод. В этом оптическом методе применен луч монохроматического света, который направлен на границу между покрытием и основным слоем точно таким же образом, как в микроскопическом методе исследования с помощью светового потока. Но вместо измерения отношения отраженного луча микроскоп используется для установления количества интерференционных колец, создаваемых при рассеивании света под действием уступа на границе покрытия. Число колец, умноженное на половину длины волны использованного светового луча, составляет толщину покрытия. [c.140]
Перрену удалось подсчитать коллоидные частицы оптическим методом, хотя, как правило, они настолько малы, что их нельзя заметить при наблюдении в обычный микроскоп. Успех эксперимента Перрена обязан эффекту Тиндаля, который представляет собой рассеяние света коллоидными частицами. Если частицы освещаются светом, направленным приблизительно под углом 90° по отношению к линии наблюдения, рассеянный ими свет зрительно воспринимается как световые пятнышки, которые нетрудно наблюдать в микроскоп при умеренном увеличении (приблизительно 200 х ). Этим способом можно отличить золь от молекулярных или ионных растворов последние не способны рассеивать свет. [c.500]
Успех эксперимента Перрена обязан эффекту Тиндаля, который представляет собой рассеяние света коллоидными частицами. Если частицы освещаются светом, направленным приблизительно под углом 90° по отношению к линии наблюдения, рассеянный ими свет зрительно воспринимается как световые пятнышки, которые нетрудно наблюдать в микроскоп при умеренном увеличении (приблизительно 200 х ). Этим способом можно отличить золь от молекулярных или ионных растворов последние не способны рассеивать свет. [c.500]
Световая микроскопия относится к визуальным методам, основанным на использовании электромагнитных колебаний с длиной волны, намного меньшей размеров изучаемого объекта. Применительно к полимерам метод позволяет определить размеры и форму надмолекулярных образований не менее 0,4 мкм, поскольку использует длину волны видимого света (0,4-0,8 мкм), и применяется для изучения морфологии поликристаллов, изучения толщины и поперечного сечения образцов. Этим методом можно изучать распределение концентрации и ориентацию наполнителя (в том числе, резины как наполнителя для других полимеров), взаимодействие между резиновой матрицей и наполнителем, исследовать поверхность резин. [c.195]
[c.195]
Световая микроскопия сегодня чаще всего использует поляризованное излучение, поскольку кристаллизация и ориентация обусловливают эффект двойного лучепреломления. В частности, для получения информации об упорядоченном состоянии надмолекулярных образований предлагается [6] использовать экспериментальную зависимость рассеяния поляризованного света от величины угла рассеяния. [c.354]
Качество изображения может быть улучшено за счет спектрального изменения светового потока в микроскопе, достигаемого применением светофильтров. Контрастные фильтры позволяют повышать контрастность окрашенных объектов кристаллы, имеющие одинаковую с фильтром окраску, будут иметь светлый оттенок, а кристаллы, окрашенные в цвет, дополнительный к цвету фильтра, — в темный тон. При использовании контрастных светофильтров целесообразно применение панхроматических фотоматериалов. Для уменьшения силы светового потока (яркости изображения) в соответствии с чувствительностью фотоматериала применяют различные компенсационные фильтры светоослабляющие, фильтры дневного света, теплозащитные и специальные желто-зеленые фильтры. Все эти фильтры обладают небольшим собственным поглощением света, поэтому при цветной микрофотографии их следует применять с учетом этого обстоятельства. Для выделения из видимой части спектра нужного излучения применяют избирательные фильтры — синий, зелеьый, желтый, оранжевый и красный. Эти фильтры используют в специальной флюоресцентной микроскопии. Зеленые фильтры, устраняющие остаточную аберрацию ахроматических объективов, называются корригирующими фильтрами и применяются для повышения контрастности изображения. Синие фильтры повышают разрешающую способность микроскопов. [c.117]
Все эти фильтры обладают небольшим собственным поглощением света, поэтому при цветной микрофотографии их следует применять с учетом этого обстоятельства. Для выделения из видимой части спектра нужного излучения применяют избирательные фильтры — синий, зелеьый, желтый, оранжевый и красный. Эти фильтры используют в специальной флюоресцентной микроскопии. Зеленые фильтры, устраняющие остаточную аберрацию ахроматических объективов, называются корригирующими фильтрами и применяются для повышения контрастности изображения. Синие фильтры повышают разрешающую способность микроскопов. [c.117]
Использование когерентного излучения позволило создать принципиально новый метод проекционной микроскопии, основанный на применении квантовых усилителей света. Объект с помощью объектива освещается монохроматическим светом от лазера на парах меди. Офаженный от объекта свет проходит активную среду, усиливается и проектируется на экран. Когерентные микроскопы обеспечивают высокое просфанственное разрешение (1 мкм при увеличении порядка 1000. ., 1500) при яркости изображения, недоступного обычным световым микроскопам. Особенностью микроскопа являются возможность фокусировки мощного лазерного излучения на любом элементе объекта и возможность осуществлять его коррекцию. [c.509]
., 1500) при яркости изображения, недоступного обычным световым микроскопам. Особенностью микроскопа являются возможность фокусировки мощного лазерного излучения на любом элементе объекта и возможность осуществлять его коррекцию. [c.509]
При осмотре поверхности для определения блеска при помощи светового или электронного микроскопа в поле зрения попадает очень малая часть поверхности, в то время как человеческий глаз оценивает общую поверхность. Поверхность, называемая гладкой, содержит шероховатости порядка тысячных долей миллиметра. От нее отражается рассеянный свет. Доля рассеянного отраженного света будет тем меньшей, чем больше сняты микрошероховатости, т. е. в среднем размеры их должны быть доведены по крайней мере до величины меньшей, чем длина наиболее короткой световой волны, равной 0,4 мкм. Следовательно, при электролитическом осаждении блестящих металлопокрытий кристаллизация должна идти в таком направлении, чтобы были удалены эти микрошероховатости поверхности. Напротив, макрошероховатости, величина которых значительно больше длины световой волны, могут встречаться при блестящих покрытиях. [c.59]
Факты основываются на прямьк или косвенных наблюдениях, выполненных с помощью органов чувств или приборов, таких как свето- или радиотелескопы, световые и электронные микроскопы, осциллофафы, действующих как усилители нащих чувств. Все факты, относящиеся к конкретной проблеме, называются данными. Наблюдения могут быть качественными (т. е. описывать цвет, форму, вкус, внещний вид и т. д.) или количественными. Количественные наблюдения являются более точными. Они включают измерение величины или количества, наглядным выражением которых могут служить качественные признаки. [c.377]
Флуоресцирующие красители поглощают свет одной длины волны и излучают свет другой длины волны, более длинной. Если такое вещество облучить светом, длина волны которого совпадает с длиной волны света, поглощаемого красителем, и затем для анализа использовать фильтр, пропускающий свет с длиной волны, соответствующей свету, излучаемому красителем, флуоресцирующую молекулу можно выявить по свечению на темном поле. Высокая интенсивность излучаемого света является характерной особенностью таких молекул. Применение флуоресцирующих красителей для окраски клеток предполагает использование специального флуоресцентного микроскопа. Такой микроскоп похож на обычный световой микроскоп, но здесь свет от осветителя, излучаемый мощным источником, проходит через два набора фильтров — один для задержания света перед образцом и другой для фильтрации света, полученного от образна Первый фильтр выбран таким образом, что он пропускает свет длины волны, возбуждающей определенный флуоресцирующий краситель в то же время второй фильтр блокирует этот падающий свет и пропускает на окуляр свет длины волны, излучаемой красителем при его флуоресценции (рис. 4-6). Флуоресцентная микроскопия часто используется для выявления специфических белков или других молекул, которые становятся флуоресцирующими после ковалентного связывания с флуоресцирующими красителями. Например, флуоресцирующие красители могут быть связаны с молекулами антител, что сразу же превращает их в высокоспенифические и удобные красящие реагенты, селективно связывающиеся со специфическими макромолекулами на поверхности живой либо внутри фиксированной клетки (см. разд. 4.5.3). Для этой цели обычно используют два красителя — флуоресцеин, который дает интенсивную желто-зеленую флуоресценцию после возбуждения светло-голубым светом, и родамин, обусловливающий темно-красную флуоресценцию после возбуждения желто-зеленым светом (рис. 4-7). Применяя [c.177]
Общая схема просвечивающего электроппого микроскопа (ПЭМ) напоминает схему светового, хотя электронный микроскоп значительно больше и как бы перевернут (рис. 4-13). Источник излучения — нить катода, испускающая электроны с вершины цилиндрической колонны высотой около двух метров. Поскольку при столкновении с молекулами воздуха электроны рассеиваются, в колонне должен быть создан вакуум. Электроны, излучаемые катодной нитью, ускоряются ближайшим анодом и проникают через крошечное отверстие, формируя электронный луч, проходящий в нижнюю часть колонны. Вдоль колонны на некотором расстоянии расположены кольцевые магниты, фокусирующие электронный луч, подобно стеклянным линзам, фокусирующим луч света в световом микроскопе. Образец через воздушный шлюз помещают в вакуум колонны, на пути электронного пучка. Часть электронов в момент прохождения через образец рассеивается согласно плотности вещества в данном участке, остаток электронов фокусируется и образует изображение (подобно формированию изображения в световом микроскопе) на фотопластинке или на фосфоресцирующем экране. [c.181]
Протобиополимеры, синтезированные в условиях холодной плазмы, и в особенности смеси, богатые липидными структурами, во время размораживания претерпевают самосборку в стабильные микросферы, однородные по размерам (диаметр 10— 50 мкм) (рис. 62). Для их изучения были использованы следующие методы оптическая микроскопия электронная микроскопия (срезы и цельные микросферы) оптическая микроскопия в поляризованном свете растровая электронная микроскопия (РЭМ) электронная микроскопия по методу замораживания — скалывания проверка на устойчивость к термическому и световому воздействию проверка на устойчивость к изменениям pH испытание механической прочности исследование мембранных свойств изучение связывания биологически активных соединений. [c.95]
Мезофазные сферы в момент их возникновения и при последующем росте, по данным световой микроскопии в поляризованном свете, а также дифракционного и рентгеноструктурного анализов, являются оптически одноосными положительными кристаллами гегсагональной системы. Показанные на рис. 2-4, а изгибы слоев приводят к тому, что на краях они перпендикулярны к касательной поверхности сферы. Это, по-видимому, способствует начальной коалесценции. В условиях относительно низкой подвижности мезофазы и случайной взаимной ориентации коалесцирующих сфер образования простой слоистой структуры не происходит. При этом возникают структуры, отличающиеся множеством дефектов упаковки слоев линейных, изгибов, нарушений непрерывности. Исследования профилей рефлексов (002) рентгенограмм мезофазы с учетом эффектов гьбсорбции и поляризации рентгеновских лучей, а также фактора рассеяния атомов углерода показывают, что средние значения межслоевого расстояния 002 равны примерно 0,350 нм [2-89]. Отдельные пачки слоев с разными значениями межслоевого расстояния имеют размеры до 2 нм. При нагревании сферы мезофазы могут расщепляться и приобретать относительно плоскую конфигурацию. То же происходит и при графитации мезофазы. Флуктуация межслоевых расстояний у графитирующейся мезофазы наивысшая. [c.46]
Макро- и микроструктура коксов оценивается с помощью световой микроскопии в основном в поляризованном свете, а также сканирующей и просвечивающей электронной микросконии. [c.55]
Взаимодействие света с веществом зависит от соотношения длины волны света и размеров частиц, на которые падает световой поток. Это взаимодействие происходит по законам геометрической оптики (отражение, преломление), если размеры объекта больше длины волны света. Если размеры частиц меньше половины длины волны света, то происходит рассеивание света в результате его дифракции. Область видимого света характеризуется длиной волн от 760 до 400 нм. Поэтому в молекулярных и коллоидных системах видимый свет рассеивается, а в проходящем свете эти растворы прозрачны. Наибо.льшей интенсивности рассеивание света достигает в коллоидных системах, для которых светорассеяние является характерной качественной особенностью. Обнаружение в растворе пути луча источника света при рассматривании раствора перпендикулярно к направлению этого луча позволяет отличить коллоидный раствор от истинного. На этом же принципе основано устройство ультрамикроскопа, в котором наблюдения проводят, в отличие от обычного микроскопа, перпендикулярно направлению проходящего через объект света. Схема поточного ультрамикроскопа Б. В. Дерягина и Г. Я. Власенко приведена на Рис. 10.6. Схема поточного ультрами-рис. 10.6. с помощью этого прибора кроскопа В. В. Дерягина и Г. Я. Вла-определяют концентрацию дисперс- сенко 1 — кювета 2 — источник света ных частиц в аэрозолях и коллоид- 3 — линза 4 — тубус микроскопа, ных растворах. [c.297]
В качестве светового микроскопа применяется исследовательский микроскоп — вариант прибора Zetopan, дающий возможность проводить исследования в проходящем или отраженном свете в светлом и темном поле, при фазовом контрасте, поляризации света и флюоресценции. С помощью прибора можно идентифицировать частицы, определить их количество, площадь и длину, про- [c.129]
Методы световой микроскопии различаются по способу освещения объекта исслс.аования в проходящем свете, в отраженном, свете (для непрозрачных объектов). при боковом осветег ич (ультра-микрпскопия). Эти методы пригодны для дисперсионного анализа порошков, суспензий, эмул1-сий, пен, аэрозолей. [c.392]
Разрещаемое расстояние светового микроскопа можно снизить до 1000 А, если увеличить показатель преломления среды между предметом и объективом или проводить измерения в ультрафиолетовом свете. Для дальнейшего снижения разрешаемого расстояния [c.167]
Как видно из рис. VI. 16 и в, оптическая схема электронного микроскопа просвечивающего типа в основных чертах напоминает оптическую схему обычного светового микроскоца (рис. VI. 1а) с тем отличием, что в электронном микроскопе источник света заменен источником электронов, а стеклянные линзы — электромагнитными или электростатическими. Электронные лучи создаются и формируются специальной электронно-оптической системой, которая называется электронной пушкой. Нагретая до высокой температуры вольфрамовая пить 1 (рис. VI.16 и й) эмитирует электроны, которые, попадая в ускоряющее поле электронной пушки, образуют пучок. В центре анода имеется небольшое отверстие, через которое пролетают электроны, используемые в дальнейшем для образования изображения. Далее электронный пучок попадает в конденсорную линзу 2, которая фокусирует его на исследуемый объект 3. Пройдя через объект, электронные лучи попадают в поле объективной линзы 4, которая создает промежуточное изображение 5, а затем в проекционную линзу 6, направляющую электронные лучи на флюоресцирующий экран и образующую конечное изображение 7. Флюоресцирующий экран покрыт веществом, способным светиться под действием ударов электронов (сульфид цинка, сульфид кадмия). Благодаря этому электронное изображение превращается в световое и становится видимым. Электронное изображение может быть зафиксировано на фотопластинке. [c.170]
В первой группе методов измеряют линеЙЕСые размеры частиц (или пор) с помощью оптич. микроскопа (обычно реализуемый предел измерений-от 1 мкм до неск. мм) или электронного микроскопа (от 1 нм до неск. мкм) изменения электрич. сопротивления, или светового потока при про пускании суспензии через тонкий канал, вызванные попа данием в этот канал частицы дисперсной фазы (т. наз счетчики Культера позволяют измерять размеры частиц от 0,1 до 100 мкм, оптич. приборы-от 5 до 500 мкм) интенсивность света, рассеянного единичной частицей, с по мощью ультрамикроскопа или поточного ультрамикроско па Дерягина-Власенко (частицы размером от 2 до 500 нм). [c.78]
В основе У. лежит дифракция света на колловдных частицах, размер к-рых меньше половины длины световой волны, в результате чего система начинает светиться. Частицы можно наблюдать в УМ как яркие дифракц. пятна, изучать их природу, оценивать концентрацию, однако изображений частиц микроскоп не создает. Яркость свечения, а следовательно, и видимость частиц зависят от разности показателей преломления частицы и дисперсионной среды. Если она велика (напр., взвесь металлич. частиц в воде), то отчетливо фиксируются частицы размерами 2-4 нм (т.е. значительно меньше предела разрешения обычных микроскопов). Если эта разность мала (взвесь орг. частиц в воде), то обнаруживаются только частицы размерами не менее 20-40 нм. В лиофильных коллоидах (напр., гелях желатины, декстрина) пов-сть частиц вследствие сольватации не обладает заметной разницей в показателях преломления относительно дисперсионной среды (воды), поэтому свечение в них знач1ггельно слабее. [c.36]
Схема, предложенная Бэрчем [46] для интерференционной голографии прозрачных объектов, позволяет получить интерференционную голограмму фазового объекта при однократной экспозиции, но качество таких интерферограмм ниже, чем прп использовании двухступенчатого метода. Интерферометр Бэрча работает как интерферометр с диффузным стеклом его характеристики подобны характеристикам дифракционного интерферометра, описанного Краусхаром. Параллельный световой пучок малого диаметра, испускаемый лазером, расширяется вогнутой линзой (или объективом микроскопа). Мнимая фокальная плоскость этого расходящегося пучка проецируется в плоскость исследуемого участка t—1 линзой L и объективом ь Пучок частично рассеивается диффузным стеклом 5Р, расположенным в фокальной плоскости объектива 1 и выполняющим функцию делителя светового пучка. Основной пучок (сплошные линии) минует фазовый объект и используется в качестве сравнительного иучка. Рассеянный свет (штриховые линии) проходит через фазовый объект, в котором происходит сдвиг фаз. Фотопластинка НР, на которую фотографируется голограмма, расположена в фокальной плоскости объектива Ьо. Плоскость диффузного стекла проецируется на плоскость фотопластинки объективами Ь и Ьо. Комбинация лучей основного пучка и дифрагировавшего света со сдвигом фаз дает интерференционную голограмму. Чтобы получить интерференционную картину, проявленную голограмму устанавливают на прежнее место в оптической системе (без фазового объекта). Линза съемочной камеры, например Ьз, воспроизводит интерферо1рамму в илоскости изобра- [c.80]
В этом приборе (рис 7 4) световой пучок от источника 5 направпен под прямым углом к оси микроскопа а сам аэрозоль движется ламинарно по трубке Т Наблюдатель видит вспышку света когда частица пересекает освещенную зону в одну минуту можно сосчитать до 100 вспышек Скорость аэрозоля вдоль оси трубки вычисляется по обьемнои скорости потока, а поперечное сечение [c.235]
Применяемая аппаратура сходна с аэрозольным ультрамикроскопом или с конденсатором Милликена приченявшимся в его классической работе по изме рению заряда электрона Частицы освещаются интенсивным пучком света про шедшим через тепловой фильтр и рассматриваются через горизонтальный ми кроскоп под прямым углом к световому пучку В окуляр микроскопа (обычно шестикратный) помещается микрометр с параллельными штрихами и отмечается врепя прохождения оседающей частицеи определенного расстояния Затем по уравнению Стокса — Канингэма вычисляется размер частицы [c.240]
Разрешающая способность микроскопа, т. е. наименьшее расстояние, при котором две точки еще можно видета раздельно, составляет около половины длины световой волны. Таким образом, при использовании обычного света (длина волны 400-700 нм ) даже в наилучший микроскоп видимы частицы, размеры которых не менее 2 10г см, т. е. коллоидные частицы лежат за пределами видимости в обычном микроскопе. [c.94]
Определить их месторасположение под световым микроскопом можно посредством сыворотки, связанной с флюорохромом (флюоросцеин, родамин), который испускает зеленый или красный свет после возбуждения облучением с точно установленной длиной волны. [c.128]
Даже иммерсионные микроскопы (разрешающая способность 0,2 нм) не всегда дают возможность визуально обнаружить частицы дисперсной фазы в коллоидных растворах. В то же время поперечник частиц в золях уже настолько велик (больше 7г световой волны), что свет не может свободно проходить через них и подвергается большему или меньшему рассеянию. Благодаря светорассеянию золи характеризуются феноменом Тиндаля и всегда, особенно в отраженном свете, кажутся опа-лесцирующими, мутноватыми или просто мутными. [c.186]
Клетки крови человека под микроскопом
Назад к спискуЕсли вы рассмотрели все доступные предметы под микроскопом, то сейчас самое время усложнить технику наблюдения и расширить исследуемые объекты. С помощью прибора можно заглянуть в ту часть природы, из которой состоим мы. Рассмотрим, как выглядят наши клетки крови под микроскопом.
Оборудование
Чтобы исследовать кровь, используют разные методы окраски материала: по Романовскому-Гимзе (самый распространенный), по Маю-Грюнвальду, по Паппенгейму или по Райту. Окраска помогает выделить структуру клетки и способствует более детальному ее рассмотрению. Для этого нужно приобрести готовый красящий раствор или порошок, состоящий из азура и эозина. Они всегда есть в продаже в специализированных магазинах.
Исследуют кровь в домашних условиях с помощью светового микроскопа, используя разное увеличение. Например, при 150х можно рассмотреть множество мелких клеток.
При среднем увеличении от 400х – 600х различаются эритроциты и среди них лейкоциты.
Для более глубокого изучения используют увеличение от 1000х и более. В этом случае можно детально рассмотреть структуру каждой клетки.
Как выглядят клетки крови под микроскопом?
Наша кровь состоит из нескольких видов клеток, выполняющих три основные функции:
- доставляют кислород к органам и тканям;
- защищают от вредных микроорганизмов;
- поддерживают постоянную внутреннюю среду.
Эритроциты под микроскопом
Самая многочисленная группа круглых клеток — эритроциты. Глядя в микроскоп, вы их увидите сразу. Эритроциты переносят кислород ко всем клеткам организма и имеют розовый цвет.
Лейкоциты под микроскопом
Среди огромного количества эритроцитов вы увидите лейкоциты: лимфоциты, моноциты, базофилы, нейтрофилы и эозинофилы. Подробно их можно разглядеть при увеличении не менее 1000х. Лейкоциты защищают организм человека от различных заболеваний, вызванных вирусами, бактериями, грибками. В борьбе с ними многие лейкоциты погибают.
Малый лимфоцит
Средний лимфоцит
Моноцит
Базофил
Сегментоядерный нейтрофил
Эозинофил
Тромбоциты под микроскопом
Тромбоциты отвечают за свертываемость крови. Это очень маленькие круглые клетки. Если у вас профессиональный микроскоп с увеличением больше 1000х, то вы их точно увидите.
Мы предоставили небольшой материал о том, как выглядят клетки крови человека под микроскопом с фото, но настоящее исследование с использованием собственного прибора этого не заменит. Если микроскопия станет вашим хобби, то вы откроете для себя потрясающие вещи! Например, вы когда-нибудь задумывались над тем, почему СОЭ (скорость оседания эритроцитов) выше нормы у больного человека? Рассмотрите воспаленную кровь и найдете ответ! Сколько удивительных открытий можно сделать прямо сейчас!
Здесь даже не нужно покупать очень сложное и дорогостоящее оборудование (пусть этим занимаются лаборатории!), но стоит задуматься о приобретении доступной оптической техники среднего класса. Такая покупка даст потрясающую возможность открыть для себя тайны микромира, не доступного нашему глазу!
Предлагаем вашему вниманию микроскопы интернет-магазина Veber.ru, с помощью которых вы сможете изучить клетки крови в мельчайших подробностях:
Назад к списку
Биологический микроскоп | Микроскопия — Микросистемы
|
|
|
|
|
Прямой лабораторный микроскоп CX43 Доступно: светлое поле (BF), тёмное поле (DF), флуоресценция (FL), поляризация (POL), фазовый контраст (PH) |
Прямой исследовательский микроскоп BX63 Доступно: светлое поле (BF), тёмное поле (DF), флуоресценция (FL), поляризация (POL), ДИК (DIC), фазовый контраст (PH) |
Инвертированный микроскоп IX73 Доступно: светлое поле (BF), флуоресценция (FL), контраст Хоффмана (RC), ДИК (DIC) фазовый контраст (PH) |
В биологии используются различные микроскопы с эндоскопическим (проходящим) освещением. Есть работы, подразумевающие пользование ртутных ламп, LED, лазеров, иного источника возбуждающего света для флуоресценции окрашенных образцов. Крайне редко применяются микроскопы с эпископическим (отражённым/падающим) освещением, потому что круг их применения ограничивается изучением поверхности, непрозрачных, пористых объектов, например, чешуи, костной, зубной ткани, раковин мелких моллюсков, ракообразных, некоторых водорослей. Исследовательское оборудование всегда сочетает в себе несколько видов освещения, между ними должно быть удобно переключаться.
Отличительные особенности биологического микроскопа:
-
эндоскопическое освещение, для изучения прозрачных, полупрозрачных объектов
-
флуоресцентная лампа, для дифференциальной визуализации окрашенных клеток
-
большинство наблюдений в светлом поле, тёмном, с иммерсией
-
зажимы для лабораторной посуды или предметных стёкол
-
инкубационные камеры и работа с культурами in-vitro
-
микроманипуляторы для ЭКО и других исследований
-
множество светофильтров
-
конденсор с различными вставками и режимами освещения
- инкубационные камеры для роста клеток
У таких приборов есть два основных вида компоновки: прямые и инвертированные
В первом случае, Вы сможете легко смотреть препараты на предметных стёклах в максимальном, доступном оптике, увеличении. Этот микроскоп применяют в школах, университетах, училищах, дома, поэтому каждому человеку интуитивно понятна логика перемещения образца и необходимая подготовка стёкол. Используя инвертированную компоновку можно просматривать живые культуры, колбы, чашки, флаконы, планшеты с лунками, микробиологические матрацы, не опасаясь касания биоматериала, не нужно думать о загрязнении, повреждении чечевиц.
Ранее применялись государственные стандарты для подбора микроскопа под определённые задачи
ГОСТ 8284-78 – «Микроскопы световые биологические. типы, основные параметры и размеры» – недействителен.
ГОСТ 8211-56 – «Микроскопы биологические. Столики предметные. Размеры и расположение отверстий под приспособления» – недействителен.
ГОСТ 8284-67 – «Микроскопы биологические. Типы. Основные параметры и размеры» (Указатель 1980 «Государственные стандарты СССР. Том 3») – недействителен.
В настоящее время, руководствуются отраслевыми стандартами, написанными научно-исследовательскими центрами, предприятиями, подразделениями академии наук и её членами. Требования к оборудованию не содержат информации о моделях, производителях, материалах изготовления, характеристиках оптических систем. В общих чертах, указываются только методы контрастирования, кратность увеличения и вид микроскопа. Этого недостаточно, для точного подбора оборудования, в виду невозможности определить:
- наблюдаемое линейное увеличение, не зная кратности окуляров
- разрешение оптической системы
- типа коррекции оптической системы
- спектральный диапазон пропускания фильтров
- тип и характеристики лампы.
Даже зная всё вышеперечисленное, остаётся набор строго индивидуальных требований, которые предъявляют пользователи к своему рабочему месту.
Какой микроскоп нужен для биологии?
Начнём с самых простых задач, для которых понадобится лабораторный прямой микроскоп, например, Olympus CX43. Используется для исследований: анализа спермы (клеточных элементов эякулята), неклеточных элементов, осадка мочи, нативных препаратов крови, активного ила, поперечных срезов филаментов, микрофлоры в мазках, планктона и список можно продолжать до бесконечности.
Рисунок 1. Примеры снимков на LC30 с микроскопа CX43
Область применения микроскопа в биологии зависит от коррекции объективов. Обратите внимание на снимки снизу. На фотографиях ниже запечатлены водоросли. Съёмка проводилась через планахромат PLAN C.
Рисунок 2. Сравнение объективов с коррекцией планахромат и ахромат
А что будет, если установить биологические объективы PLAN C в микроскоп классом выше, например, BX43? Посмотрите на рисунок снизу, сразу станет понятно, что для большей детализации, нет необходимости сильно закрывать диафрагму и терять в освещённости.
Рисунок 3. Olympus PLAN 20x NA=0.40 в BX43
Для серьёзных биологических исследований, флуоресценции и ДИК используйте исследовательские микроскопы
Прямую компоновку предпочтительно применять биологам, занимающимися флуоресцентными наблюдениями. Разберём по порядку. Флуоресценция применяется для анализа, меченных флуорофором, участков молекул, наблюдения и регистрация сегментов хромосом. Преимуществ много, специфичность высокая и для пропускания УФ излучения требуется низкодисперсное стекло или кристаллы. Раньше использовали кристаллы флюорита, из-за чего класс оптики получил своё наименование – Fluorite. Сложная оптика дополняется непростой системой фильтров, позволяющих рассматривать образцы, окрашенные несколькими красителями одновременно. Для достоверных результатов необходимо равномерное освещение образца, обеспечивающее одинаковую резкость по всему полю зрения. Такую равномерность обеспечивают линзы структурно похожие на пчелиные соты.
Дифференциально интерференционный контраст (ДИК) в биологии
Это интересная современная разработка, передающая псевдорельеф изображения. Если Вы никогда раньше не использовали этот контраст, то представьте совмещение поляризации и фазового контраста. Получаемые окрашенные изображения, дают ценную информацию при исследовании живой материи. Из-за поляризационной картины напряжений не стоит применять пластиковую посуду, искажающую его, гораздо лучше подойдёт стекло. Дополнительные компенсаторы, λ-пластинки, могут усиливать, либо ослаблять рельефность изображения.
Поляризационные биологические исследования
Поляризацию используют во множестве прикладных наук, в том числе – биологии. Основные приёмы работы нужно почерпнуть из пособий по кристаллографии. Применяется для поиска оптических неоднородностей, определения стороны поляризации, диагностики кристаллов. Конкретика: для анализа подагры применяют поворотный поляризатор, λ пластинку и поворотный анализатор. Диагностируется болезнь по наличию кристаллов урата, с характерным негативным двулучепреломлением и свечением в скрещенных николях (поляризаторе/анализаторе). Есть специальные анализаторы для CX43 с U-GAN, где не требуется дополнительная λ пластина и вам необходимо вращать только поляризатор. Это значительно экономит время и снижает требования к специалисту. Это частный пример определения концентрации оптически активных веществ в биологических растворах, не менее распространено определение минералов примесей в растительном сырье. Для сложных почвенных экспертиз пользуются BX53P, это биологический современный поляризационный микроскоп с ортоскопией и коноскопией. Коноскопия – поляризационные наблюдения в сходящемся свете, прекрасно подойдёт, если необходимо диагностировать минералы в почве, потому что при скрещивании анализатора и поляризатора, лучи, прошедшие через линзу Бертрана, не дают картинку минерала, а представляет интерференционные эффекты, коноскопические фигуры, по которым определяют количество осей, оптический знак, относительную величину угла между оптическими осями.
По необходимым компенсаторам и поляризаторам Вы можете получить бесплатную консультацию у наших специалистов.
Тёмное поле, используемое биологами
Недорогой и эффективный способ выявления оптически активных объектов. Основан на освещении образца полым конусом света, не отражающимся в объектив. Наблюдатель видит только рассеянное от образца картинку. Таким образом можно заметить прозрачные объекты. Одной из разновидностей методик применяющей такое контрастирование, является ультрамикроскопия, при которой препарат освещается мощным потоком фотонов сбоку. Главное преимущества этого освещения: выявление частиц, размером меньше длины волны видимого спектра. Биологи, в частности ветеринары, применяют его для диагностики лептоспироза.
Рисунок 4. Treponema pallidum в тёмном поле
Фазовый контраст – нестареющая классика
С момента своего появления, самый распространённый метод контрастирования среди биологов. Бактериологи без окраски видят контуры прокариотов, работники санитарных экспертиз легко находят и диагностируют простейших, в КДЛ давно используют PH для оценки качества спермы. Тысяча применений, но настройкой этого контраста хотят заниматься не многие, и для них Olympus сделал прецентрированный фазовый контраст, реализованный в CKX53.
Инфракрасная микроскопия (ИК)
Перспективна для гематологических исследований. Сейчас тестируются ИК определение заболеваний кишечника, содержание многих метаболитов, образованных патологическими изменениями в организме, определение ангины по капле сыворотки крови пациента. Это один из спектрометрических методов исследований основанный на оценке соотношения поглощения-испускания-рассеяния инфракрасного спектра веществами. На макроуровне, с применением MVX10 или SZX16, можно оценивать особенности формирования семян, содержания различных веществ в тканях растений без необходимости их химического анализа.
Как сейчас выбрать биологический лабораторный микроскоп
Сначала определите какой штатив Вам подходит больше. Если Вы будете просматривать объекты прямо в лабораторной посуде (чашках Петри, планшетах, колбах, флаконах), то приобретайте инвертированные микроскопы, если же Вам необходимо большое увеличение и контроль морфологии мелких биологических структур, то выбирайте прямой микроскоп. Обозначьте необходимые методы исследований: дифференциальное окрашивание, ДИК, поляризация (простая или количественная, ортоскопия или коноскопия), dark field (нужна ли ультрамикроскопия с кардиоидным конденсором, либо достаточно NA=0,6). Подберите подходящую оптику, которая должна соответствовать не только предполагаемому контрастированию, но и качеству изображения, которым Вы будете довольны. Приведём классификацию ниже:
Монохроматы – объективы, с исправленными аберрациями для одной длины волны или очень узкой спектральной области, исправлены сферические искажения, кома и астигматизм. Ахроматы исправлены по двум длин волн (узких спектральных диапазонов), скорректированы по: сферические искажения, коме, астигматизму, хроматичезмы положения и, частично, сферохроматические ошибки. Предназначены для работы в спектральной области от линии F (λ=486нм) до C (λ=656нм). У апохроматов коррекция расширена и распространяется на три длины волны, исправлены: вторичный спектр и сферохроматические отклонения, благодаря наличию особых линз и кристаллов с особым ходом частных относительных дисперсий. Распространены половинные решения, такие как полуапохроматы, полуахроматы, которые могут называться иначе: планфлуориты, план С.
Качественно оценивают получаемую картину по волновым аберрациям. У ахроматов для точки на оси волновые отклонения основного цвета, как правило не превышает 0,25λ, а для всей спектральной области, на которую они рассчитаны, не более 0,5λ. Сферическое искажение в апохроматических объективах не превышает 0,1-0,15λ. Для спектральных линий C и F – не более 0,25λ. У самых высоко апертурных объективов (NA>0,95), по краям величины могут быть выше 0,5λ, из-за отклонений высшего порядка, но образ всё равно контрастное и качественное.
План делятся на планахроматы (PLN), планполуапохроматы (UPLFLN) и планапохроматы (PLAPON). они аналогичны соответствующим ахроматами и прочим, но в них существенно лучше исправлены кривизна поверхности и астигматизм, а волновые аберрации в пределах всего поля не превышают 0,5λ.
Выбор конденсора очень важен для биологического микроскопа, потому что от этого также зависит разрешающая способность всего микроскопа
Конденсоры, как и остальная оптика, подразделяются по степени коррекции аберраций, рабочему расстоянию, числовой апертуре и дополнительным вставкам для контраста. Это очень важный модуль микроскопа, от этого зависит равномерность освещения образца. Этот компонент недооценивается многими потому, что в школьных микроскопах на уроках биологии он отсутствует, есть лишь зеркало и отверстие в столике, но для себя, необходимо сравнить картины, получаемое без конденсора, и с ним. Дело в том, что некогерентный и ненаправленный свет от лампы, распространяется во всех направлениях, частично отражаясь и рассеиваясь, а значит на предметное стекло, попадает, не более 15-20%. Именно электромагнитные волны формируют картинку, и от их количества зависит разрешающая способность всей системы. Апертура – это угол, под которым линза собирает или испускает лучи, если у конденсора она выше, чем у объектива, то лучи, проходящие мимо детектора просто засоряют рисунок. Когда происходит обратное, у чечевиц NA выше, они не раскроют весь свой потенциал.
Заключение
Значимость микроскопии в биологических лабораториях трудно переоценить. Основные направления развития: новые способы контрастирования, селективные флюорофоры, спектрометрические методы, линзы сверхвысокого разрешения, съёмка на камеры с высокими выдержкой или фреймрейтом. Вплотную к оптическому пределу подошли конфокальные системы, а атомно-силовые микроскопы (АСМ) даже преодолели его.
По вопросам консультации и поставки — свяжитесь с нами любым удобным способом:
+7 (495) 234-23-32
Форма обратной связи
Как рассмотреть нанообъект в оптический микроскоп
А. Ежов
«Квант» №2, 2010
Как известно, основную долю информации об окружающем мире человек получает с помощью зрения. Глаз человека — сложный и совершенный прибор. Этот созданный природой прибор работает со светом — электромагнитным излучением, диапазон длин волн которого находится между 400 и 760 нанометрами. Цвет, который при этом воспринимает человек, изменяется от фиолетового до красного.
Электромагнитные волны, соответствующие видимому свету, взаимодействуют с электронными оболочками атомов и молекул глаза. Результат этого взаимодействия зависит от того, в каком состоянии находятся электроны этих оболочек. Свет может поглощаться, отражаться или рассеиваться. Что именно произошло со светом, может многое рассказать об атомах и молекулах, с которыми он взаимодействовал. Диапазон размеров атомов и молекул от 0,1 до десятков нанометров. Это во много раз меньше, чем длина волны света. Тем не менее, объекты именно таких размеров — назовем их нанообъектами — очень важно увидеть. Что же надо для этого сделать? Обсудим сначала, что может рассмотреть человеческий глаз.
Обычно, когда говорят о разрешающей способности того или иного оптического прибора, оперируют двумя понятиями. Одно из них — угловое разрешение, а второе — линейное разрешение. Эти понятия взаимосвязаны. К примеру, для человеческого глаза угловое разрешение составляет приблизительно 1 угловую минуту. При этом глаз может различить два точечных объекта, удаленных от него на 25–30 см, только тогда, когда расстояние между этими объектами больше чем 0,075 мм. Это вполне сравнимо с разрешением обычного компьютерного сканера. В самом деле, разрешение 600 точек на дюйм означает, что сканер может различить точки, расположенные на расстоянии 0,042 мм друг от друга.
Для того чтобы можно было различать объекты, расположенные на еще меньших расстояниях друг от друга, был придуман оптический микроскоп — прибор, увеличивающий разрешающую способность глаза. Выглядят эти приборы по-разному (что видно из рисунка 1), но принцип действия у них один тот же. Оптический микроскоп позволил отодвинуть предел разрешения до долей микрона. Уже 100 лет назад оптическая микроскопия сделала возможным изучать объекты микронных размеров. Однако тогда же стало ясно, что простым увеличением количества линз и улучшением их качества добиться дальнейшего увеличения разрешающей способности невозможно. Разрешение оптического микроскопа оказалось ограничено свойствами самого света, а именно его волновой природой.
Еще в конце позапрошлого века было установлено, что разрешение оптического микроскопа составляет . В этой формуле λ — длина волны света, а nsin u — числовая апертура объектива микроскопа, которая характеризует как микроскоп, так и то вещество, которое находится между объектом изучения и самой близкой к нему линзой микроскопа. И действительно, в выражение для числовой апертуры входят показатель преломления n среды, находящейся между объектом и объективом, и угол u между оптической осью объектива и самыми крайними лучами, которые выходят из объекта и могут попасть в этот объектив. Показатель преломления вакуума равен единице. У воздуха этот показатель очень близок к единице, у воды он составляет 1,33303, а у специальных жидкостей, используемых в микроскопии для получения максимального разрешения, n доходит до 1,78. Каким бы ни был угол u, величина sin u не может быть больше единицы. Таким образом, разрешение оптического микроскопа не превышает долей длины волны света.
Обычно считается, что разрешение составляет половину длины волны.
Интенсивность, разрешение и увеличение объекта — разные вещи. Можно сделать так, что расстояние между центрами изображений объектов, которые расположены в 10 нм друг от друга, будет 1 мм. Это будет соответствовать увеличению в 100 000 раз. Тем не менее, различить, один это объект или два, не получится. Дело в том, что изображения объектов, размеры которых очень малы по сравнению с длиной волны света, будут иметь одинаковые форму и размеры, не зависящие от формы самих объектов. Такие объекты называют точечными — их размерами можно пренебречь. Если такой точечный объект светится, то оптический микроскоп изобразит его в виде светлого кружка, окруженного светлыми и темными кольцами. Будем далее, для простоты, рассматривать именно источники света. Типичное изображение точечного источника света, полученное с помощью оптического микроскопа, показано на рисунке 2. Интенсивность светлых колец намного меньше, чем у кружочка, и убывает по мере удаления от центра изображения. Чаще всего видно только первое светлое кольцо. Диаметр первого темного кольца равен . Функция, которая описывает такое распределение интенсивности, называется функцией рассеяния точки. Эта функция не зависит от того, каково увеличение. Изображение нескольких точечных объектов будет представлять собой именно круги и кольца, как это видно из рисунка 3. Полученное изображение можно увеличивать, однако если изображения двух соседних точечных объектов сливаются, то они будут сливаться и дальше. Такое увеличение часто называют бесполезным — большие изображения просто будут более размытыми. Пример бесполезного увеличения показан на рисунке 4. Формула часто называется дифракционным пределом, и она настолько знаменита, что именно ее высекли на памятнике автору этой формулы — немецкому физику-оптику Эрнсту Аббе.
Конечно, со временем оптические микроскопы стали снабжать разнообразными устройствами, позволяющими запоминать изображения. Человеческий глаз дополнили сначала пленочные фото- и кинокамеры, а потом — камеры, в основе которых лежат цифровые устройства, преобразующие попадающий на них свет в электрические сигналы. Самыми распространенными из таких устройств являются ПЗС-матрицы (ПЗС расшифровывается как прибор с зарядовой связью). Количество пикселей в цифровых камерах продолжает расти, однако само по себе это не может улучшить разрешение оптических микроскопов.
Еще двадцать пять лет назад казалось, что дифракционный предел непреодолим и что, для того чтобы изучать объекты, размеры которых во много раз меньше, чем длина волны света, необходимо отказаться от света как такового. Именно таким путем пошли создатели электронных и рентгеновских микроскопов. Несмотря на многочисленные преимущества таких микроскопов, задача использования именно света для рассматривания нанообъектов оставалась. Причин для этого было много: удобство и простота работы с объектами, небольшое время, которое требуется для получения изображения, известные способы окрашивания образцов и многое другое. Наконец, после долгих лет напряженной работы стало возможным рассматривать нанообъекты с помощью оптического микроскопа. Наибольший прогресс в этом направлении достигнут в области люминесцентной микроскопии. Конечно, дифракционный предел никто не отменял, но его удалось обойти. В настоящее время существуют различные оптические микроскопы, позволяющие рассматривать объекты, размеры которых намного меньше длины волны того самого света, который создает изображения этих объектов. Все эти приборы объединяет один общий принцип. Попробуем пояснить, какой именно.
Из того, что уже говорилось о дифракционном пределе разрешения, ясно, что увидеть точечный источник не так уж сложно. Если этот источник обладает достаточной интенсивностью, его изображение будет отчетливо видно. Форма и размер этого изображения, как уже говорилось, будут определяться свойствами оптической системы. При этом, зная свойства оптической системы и будучи уверенными в том, что объект точечный, можно определить, где именно находится объект. Точность определения координат такого объекта достаточно высока. Иллюстрацией этого может служить рисунок 5. Координаты точечного объекта можно определить тем точнее, чем интенсивнее он светится. Еще в 80-х годах прошлого века с помощью оптического микроскопа умели определять положение отдельных светящихся молекул с точностью в 10–20 нанометров. Необходимым условием столь точного определения координат точечного источника является его одиночество. Ближайший к нему другой точечный источник должен находиться настолько далеко, чтобы исследователь точно знал, что обрабатываемое изображение соответствует одному источнику. Понятно, что это расстояние l должно удовлетворять условию . В этом случае анализ изображения может дать очень точные данные о положении самого источника.
Большинство объектов, размеры которых намного меньше разрешающей способности оптического микроскопа, можно представить как набор точечных источников. Источники света в таком наборе находятся друг от друга на расстояниях, намного меньших величины . Если эти источники будут светить одновременно, то сказать что-либо о том, где именно они расположены, будет невозможно. Тем не менее, если суметь заставить эти источники светить по очереди, то положение каждого них можно определить с высокой точностью. Если эта точность превышает расстояние между источниками, то, обладая знанием о положении каждого из них, можно узнать о том, каково их взаимное расположение. А это означает, что получена информация о форме и размерах объекта, который представлен как набор точечных источников. Другими словами, в таком случае можно рассмотреть в оптический микроскоп объект, размеры которого меньше, чем дифракционный предел!
Таким образом, ключевым моментом является получение информации о различных частях нанообъекта независимо друг от друга. Существуют три основные группы методов, позволяющие сделать это.
Первая группа методов целенаправленно заставляет светить ту или иную часть исследуемого объекта. Самый известный из этих методов — сканирующая оптическая микроскопия ближнего поля. Рассмотрим ее подробнее.
Если внимательно изучить те условия, которые подразумеваются, когда речь идет о дифракционном пределе, обнаружится, что расстояния от объектов до линз значительно больше длины волны света. На расстояниях, сравнимых и меньших этой длины волны, картина получается другой. Вблизи любого объекта, попавшего в электромагнитное поле световой волны, существует переменное электромагнитное поле, частота изменения которого такая же, как частота изменения поля в световой волне. В отличие от световой волны, это поле быстро затухает по мере удаления от нанообъекта. Расстояние, на котором происходит уменьшение интенсивности, например, в e раз, сравнимо с размерами объекта. Таким образом, электромагнитное поле оптической частоты оказывается сконцентрированным в объеме пространства, размер которого намного меньше, чем длина волны света. Любой нанообъект, попавший в эту область, будет так или иначе взаимодействовать со сконцентрированным полем. Если тот объект, с помощью которого осуществляется это концентрирование поля, последовательно перемещать по какой-либо траектории вдоль изучаемого нанообъекта и регистрировать свет, излучаемый этой системой, то можно построить изображение по отдельным точкам, лежащим на этой траектории. Конечно, в каждой точке изображение будет выглядеть так, как показано на рисунке 2, но разрешение при этом будет определяться тем, насколько удалось сконцентрировать поле. А это, в свою очередь, определяется размерами того объекта, с помощью которого это поле концентрируется.
Самым распространенным способом такой концентрации поля является изготовление очень маленького отверстия в металлическом экране. Обычно это отверстие находится на конце заостренного и покрытого тонкой пленкой металла световода (световод часто называется оптическим волокном и широко используется для передачи данных на большие расстояния). Сейчас удается изготавливать отверстия с диаметрами от 30 до 100 нм. Таким же по величине получается и разрешение. Приборы, работающие по этому принципу, и называются сканирующими оптическими микроскопами ближнего поля. Они появились 25 лет тому назад.
Суть второй группы методов сводится к следующему. Вместо того чтобы заставлять соседние нанообъекты светить по очереди, можно использовать объекты, которые светятся разными цветами. В этом случае с помощью светофильтров, пропускающих свет того или иного цвета, можно определять положение каждого из объектов, а потом — составлять единую картину. Это очень похоже на то, что изображено на рисунке 5, только цвета для трех изображений будут различными.
Последняя группа методов, позволяющих преодолеть дифракционный предел и рассмотреть нанообъекты, использует свойства самих светящихся объектов. Существуют такие источники, которые можно «включать» и «выключать» с помощью специально подобранного света. Такие переключения происходят статистически. Иначе говоря, если имеется много переключаемых нанообъектов, то, подобрав длину волны света и его интенсивность, можно заставить «выключиться» только часть из этих объектов. Остальные объекты будут продолжать светить, и можно получить от них изображение. После этого надо «включить» все источники и снова «выключить» часть из них. Набор оставшихся «включенными» источников будет отличаться от набора, который остался «включенным» в первый раз. Повторяя такую процедуру много раз, можно получить большой набор изображений, отличающихся друг от друга. Анализируя такой набор, можно установить местоположение большой доли всех источников с очень высокой точностью, значительно превышающей дифракционный предел. Пример сверхразрешения, полученного таким способом, приведен на рисунке 6.
В настоящее время оптическая микроскопия со сверхразрешением быстро развивается. Можно со всей уверенностью предполагать, что в грядущие годы эта область будет привлекать все большее число исследователей, и хочется верить, что среди них будут и читатели этой статьи.
Что в световой микроскоп можно увидеть?
Свойства объёмного стекла увеличивать изображение были знакомы людям очень давно. Самая древняя линза, найденная археологами в Ираке близ города Нимруд, датируется VIII веком до нашей эры. Изобретатели этого полезного приспособления так и остались неизвестными. Неясно также, кто впервые применил его для создания микроскопа. Есть достоверные сведения, что комбинации из двух линз для своих приборов использовали знаменитые учёные XVI-XVII веков — Галилео Галилей, Джироламо Фракасторо, Кристиан Гюйгенс. История умалчивает, были эти приспособления изобретены до них, или нет. Но именно в ту эпоху оптика стала впервые применяться для изучения микромира.
Исследователи быстро поняли, что при использовании сразу нескольких линз их кратности увеличения предметов не складываются, а перемножаются друг на друга. И это даёт значительный эффект, позволяющий рассмотреть объекты микромира. Проблема состояла в том, что первые линзы были несовершенны и достаточно грубо обработаны. Поэтому изображение получалось с дефектами, которые увеличивались вместе с объектом исследований. Для решения этой проблемы разрабатывались микроскопы с единственной мощной линзой, один из которых позволил Антони Ван Левенгуку разглядеть растительную клетку. Лишь через полтора столетия многосоставные микроскопы, обладающие несколькими линзами, завоевали широкую популярность среди учёных. А с появлением электричества стала использоваться подсветка, значительно облегчившая процесс наблюдения. Именно так появился прибор, схожий по принципу работы с современным световым микроскопом.
Принцип работы
Световой микроскоп использует одно из неотъемлемых свойств луча света — преломление. Лучи подсветки отражаются в зеркальце, расходятся от объекта и параллельным пучком идут внутри тубуса, в котором размещены линзы. При помощи линз лучи преломляются, т.е. изменяют угол своего падения таким образом, что происходит их концентрация на сетчатке глаза. Таким способом объект наблюдения увеличивается и проступают его незаметные прежде детали.
Кратности увеличения
Окуляром микроскопа называется линза, в которую непосредственно смотрит глаз наблюдателя. Обычно для этих целей используются линзы с десятикратным увеличением. Ниже, в тубусе, располагается ряд объективов, каждый из которых имеет своё увеличение — 4, 10, 40 или же 100. Поскольку кратности перемножаются, то, в зависимости от выбранного объектива в сочетании с десятикратным окуляром, можно достигать кратности от 40 до 1000 соответственно.
Обычно наблюдение начинают с выбора четырёхкратного объектива, дающего наименьшее увеличение в 40 раз. Зачем? Дело в том, что для подробного рассмотрения какого-либо объекта нужно сперва этот объект найти. Осуществлять такой поиск при слишком большом увеличении неудобно. Поэтому при изучении микроскопического предмета, как правило, начинают от самого малого увеличения к большему. Объектив с маленьким увеличением позволяет гораздо быстрее фокусироваться, чем с большим.
Полезное и бесполезное увеличение
Увеличение бывает как полезным,так и бесполезным. В чём разница между тем и другим? Дело в том, что возможности любого светового микроскопа имеют предел. Теоретически возможно, используя множество линз, увеличить кратность прибора до бесконечности.
Но на практике наступает предел, после которого дальнейшее увеличение не делает видимыми новые детали объекта. До этого предела увеличение считается полезным, а после — бесполезным.
Разрешающая способность
Увеличивать изображение до бесконечности нет смысла потому, что разрешающая способность прибора конечна. Этой способностью называется расстояние между двумя близкими линиями, позволяющее видеть их раздельно. Для светового микроскопа такое расстояние достигает максимум 0,2 мкм. Именно этот фактор, а вовсе не конечные значения кратности, ограничивают область применения световой микроскопии. Более мелкие объекты доступны электронным и другим более современным микроскопам.
Устройство на базе школьного микроскопа
бъектив представляет собой цилиндр из металла (тубус), в который вмонтированы несколько линз. Его увеличение обозначают цифры.
Две или три линзы используются для окуляра. Предназначение расположенной между ними диафрагмой — фокусировка поля зрения. Нижней линзой фокусируются исходящие от объекта лучи, а само наблюдение происходит с помощью верхней.
В осветительном устройстве используются зеркало или электрический осветитель. Важной деталью является наличие конденсора, в состав которого входят две или три линзы. Подымаясь или опускаясь на кронштейне со специальным винтом, он может концентрировать или рассеивать свет, падающий на объект. Диаметр потока света изменяется специальной диафрагмой управляемый рычажком. Степень освещённости объекта регулирует кольцо, имеющее матовое стекло или светофильтр.
Составляющие механической системы микроскопа:
- Подставка.
- Коробка с микрометренными приспособлениями.
- Тубус.
- Тубусодержатель.
- Винт грубой наводки.
- Кроншетейн и винт перемещения конденсора.
- Револьвер.
- Предметный столик.
На предметном столике располагается объект наблюдения. Микрометренные механизмы предназначены для небольших перемещений тубусодержателя с тубусом, чтобы расстояние между объективом и объектом было оптимальным для наблюдения. Для более значительного смещения используют винты, осуществляющие грубую наводку. Функция револьвера — быстрая смена объективов. Это чрезвычайно удобное приспособление, которого не имели первые микроскопы, поэтому испытатели прошлого вынуждены были тратить на данную процедуру чрезвычайно много времени и усилий. Кронштейн, на котором держится конденсор, также способен подниматься и опускаться при помощи винта.
Что изучает световой микроскоп
Обычно в световой микроскоп рассматривают микроскопические биологические объекты. Именно с его помощью была открыта живая клетка. Сегодня с помощью светового микроскопа можно исследовать целый ряд клеточных органелл, играющих важную роль в функционировании живого организма.
Именно такой микроскоп используется при преподавании школьного курса биологии.
В частности, при помощи этого прибора можно увидеть:
- Ядро клетки, являющееся основным её компонентом.
- Стенку, образующую поверхностный клеточный аппарат, включая мембрану.
- Хлоропласты, содержащие важный для растительной клетки хлорофилл, с помощью которого происходит синтез углеводородов из воды и углекислого газа.
- Митохондриальные структуры и коплекс Гольджи, важные для клеточного метаболизма.
различные виды ресничек, жгутиков, вакуолей и светочувствительных органелл.
Новейшие достижения — самые мощные микроскопы
В 2006 году исследовательской группой во главе с немецким учёным Штефаном Хелем и аргентинцем Мариано Босси была завершена разработка оптического (светового) микроскопа, ставшего настоящим прорывом в технологиях исследований с помощью высокоточной оптики. Изобретение, которое назвали наноскопом, позволяет вести наблюдение за объектами размерами менее 10 нм. При этом получаются их высококачественные изображения в трёхмерном формате. Вероятно,это не предел — исследования в разных странах, направленных на повышение разрешающей способности светового микроскопа, продолжаются.
Фильтры для микроскопов и их применение
Фильтры для микроскопов используются как для наблюдения, так и для фотомикроскопии. Каждый фильтр микроскопа используется для разных целей, и все они обычно размещаются на пути света, либо над осветителем, либо в прорези фильтра, которая находится на пути света. Некоторые фильтры микроскопа помещаются в прорезь для фильтра в корпусе осветителя, если используется внешний осветитель. Ниже вы найдете общие фильтры для микроскопов и их предполагаемое использование.Здесь можно купить все фильтры для микроскопов.
Зеленый интерференционный фильтр : Объективы микроскопов Ахромат и Планахромат лучше всего сферически корректируются для зеленого света. Это означает, что их производительность улучшается при использовании зеленого фильтра. Фазоконтрастные объективы также созданы для получения наилучшего фазового изображения в зеленом свете.
Фильтр синего дневного света : Фильтр синего света для микроскопа предназначен только для наблюдения. Он придает бледно-серо-голубой оттенок полю зрения и часто используется для балансировки света, создаваемого вольфрамовыми или галогенными лампами микроскопа, чтобы сбалансировать цвет света микроскопа.Фильтр дневного синего не предназначен для использования с микрофотографией с пленкой дневного цвета. Для цветной пленки дневного света требуется фильтр преобразования синего цвета, который повысит цветовую температуру источника света и имитирует свет дневного света с качеством цветовой температуры, требуемым для цветной пленки со сбалансированным дневным светом.
Фильтр матового стекла : Этот фильтр микроскопа часто помещают над осветителем, чтобы получить более равномерный и рассеянный свет. Фильтры из матового стекла для микроскопов часто используются с вольфрамовым источником света.
Фильтр нейтральной плотности (ND) : Фильтр микроскопа нейтральной плотности используется для уменьшения света на процент. На фильтрах ND указаны разные номера, например ND8 или ND50. ND50 означает, что свет уменьшен на пятьдесят процентов. Фильтры нейтральной плотности часто используются в микрофотографии.
Дидимиевый фильтр : Этот фильтр микроскопа известен как усиливающий фильтр. Дидимиевый фильтр изготовлен из дидимиевого стекла для увеличения интенсивности и насыщенности красных объектов.Поскольку тонкие срезы биологической ткани часто окрашивают одним или несколькими красителями, чтобы улучшить видимость особенностей в образце, при фотографировании этих образцов желательно, чтобы окрашенные цвета отображались на фотографии. Хотя большинство пятен хорошо видны на цветной пленке, некоторые выглядят размытыми. Дидимиевые фильтры помогают бороться с этой размытой проблемой.
Желтый фильтр : Желтый фильтр для микроскопа обычно используется для точной настройки цветового баланса вольфрамовых и галогенных источников света микроскопа для микрофотографии с цветной пленкой.Кроме того, есть несколько применений в металлургических микроскопах, где желтый фильтр помогает обнаруживать повреждения в металлических конструкциях.
Что такое фильтр для микроскопа и почему он используется? — Чистота микроскопа
Фильтры для микроскопии используются для фильтрации света определенной длины волны, тем самым увеличивая контраст, блокируя окружающий свет, удаляя инфракрасное или ультрафиолетовое излучение. Фильтры обычно устанавливаются над осветительным устройством под ирисовой диафрагмой.
Осветительное устройство является наиболее важной частью оптического микроскопа, так как «качество» излучаемого им света будет определять качество увеличенного изображения.Световые лучи, испускаемые источником, распространяются как электромагнитная волна, состоящая из максимумов (гребней) и минимумов (впадин). Расстояние между гребнем и впадиной называется длиной волны света.
Всем энтузиастам микроскопии необходимо понимать понятие длины волны как разрешение микроскопа прямо пропорциональна длине волны источника света. Например, в В спектре видимого света у фиолетового света самая короткая длина волны. Следовательно, источник фиолетового света дает самое высокое разрешение.
Большинство микроскопов поставляются с фиксированным источник света, который нельзя изменить. Кроме того, в зависимости от образца При осмотре может потребоваться регулировка длины волны света.
Существует широкий ассортимент фильтров, которые используются в микроскопии для различных целей, от сложных микроскопов до конфокальных лазерных сканирующих микроскопов. Ниже описаны несколько часто используемых типов.
Тип фильтров
Исходя из длин волн, разрешенных для передачи через фильтр , их можно классифицировать как:
Полосовые фильтры позволяют проходить длинам волн в определенном диапазоне.Эти фильтры определяются их начальной и конечной длинами волн, за пределами которых все длины волн блокируются / отсекаются из-за поглощения или отражения.
Длиннопроходные фильтры позволяют проходить через них только длинам волн, превышающим пороговое значение. Все длины волн ниже порогового значения поглощаются или отражаются обратно.
Short Pass Filters позволяют длинам волн ниже порогового значения проходить через устройство, блокируя все другие длины волн.
В зависимости от метода, с помощью которого фильтры блокируют пропускание света, фильтры можно классифицировать следующим образом:
Интерференционные фильтры / дихроичные фильтры отражают или деструктивно мешают неспецифическим длинам волн, отфильтровывая их.Эти фильтры представляют собой стеклянные пленки, содержащие чередующиеся слои проводящих или непроводящих материалов с различными показателями преломления.
Свет, переходящий от более низкого показателя преломления к более высокому показателю преломления, будет отражаться, и только волны определенной длины будут конструктивно мешать прохождению. Картина интерференции также зависит от угла, под которым фильтр находится на пути света. Следовательно, один и тот же фильтр можно использовать для фильтрации диапазона длин волн, изменяя угол их установки.В зависимости от покрытия эти фильтры могут быть короткими, длинными или полосовыми.
Абсорбционные фильтры устраняют нежелательные длины волн, поглощая их. Обычно это осколки окрашенного стекла / желатиновые смолы различной толщины. Поглощение фильтра пропорционально его толщине, цвету и количеству красителя. Эти фильтры обычно используются для удаления фонового шума. В отличие от интерференционных фильтров, поглощающие фильтры нечувствительны к углу; их поглощающие свойства не меняются независимо от того, в каком положении они закреплены.
В зависимости от цели, для которой используются фильтры , их можно классифицировать несколькими способами. Здесь мы суммируем только наиболее часто используемые фильтры в данной области.
Цветные фильтры обычно устанавливаются на составные микроскопы, чтобы пропускать световые волны определенных цветов. Источник света будет излучать свет всех 7 цветов: фиолетовый, индиго, синий, зеленый, желтый, оранжевый и красный. Каждый цвет дает изображение разной температуры, контрастности и яркости.Цветные фильтры блокируют прохождение определенных цветов из-за поглощения или интерференции определенных длин волн. Обычно их получают путем окрашивания осколков стекла / пластика или желатина.
Голубые фильтры дневного света: Эти фильтры поглощают весь свет между желтым и красным спектром, тем самым приближая температуру изображения к дневному свету. Отфильтровывая все длинные волны, синие фильтры улучшают разрешение изображения и его яркость. Если ваше изображение выглядит желтоватым при низкой яркости, синий фильтр вам подходит.
Желтый и зеленый фильтры: Эти фильтры используются для уменьшения хроматической аберрации и увеличения контрастности. Линза объектива исправляет аберрации в желтом и зеленом свете лучше, чем в других длинах волн. Следовательно, эти фильтры можно использовать для фильтрации всех остальных цветов в спектре и улучшения качества изображения.
Красные фильтры: Красный свет имеет самую большую длину волны и, следовательно, самое низкое разрешение. Однако красный свет эффективно снижает фоновый шум.Следовательно, в случаях, когда морфология не важна, для измерения пробы можно использовать красные фильтры.
Спектр излучения и возбуждения флуорохрома.Флуоресцентные фильтры относится к ассортименту фильтров, которые используются в флуоресцентной микроскопии. При флуоресцентной микроскопии исследуемый образец может не быть автофлуоресцентным. Поэтому искусственные красители, называемые флуорохромами / флуоресцентными зондами, используются для выборочного окрашивания частей образца.
Флуорохромы поглощают свет от осветителя и излучают свет определенной длины волны.Детектор используется для сбора и исследования этого излучения. Однако в некоторых случаях естественная автофлуоресценция образца приводит к фоновому шуму.
Фильтрымогут устранять все неспецифические длины волн, одновременно изолируя длины волн возбуждения и излучения флуорофора. Хороший флуоресцентный фильтр должен уметь увеличивать яркость, уменьшать фоновый шум и шум флуорофоров.
Система флуоресцентных фильтров состоит из трех основных компонентов:
Фильтр возбуждения фильтрует свет от осветителя до того, как он пройдет через образец.Это устройство гарантирует, что длина волны света, достигающего образца, попадает только в спектр возбуждения конкретного флуорофора.
Нежелательные длины волн могут поглощаться или отражаться в зависимости от типа покрытия. Рекомендуется выбирать фильтр возбуждения, пики которого максимально близки к средней длине волны в желаемых спектрах возбуждения. Оптическая плотность фильтра возбуждения также будет определять яркость изображения и темноту фона.
Дихроичный светоделитель помещается на пути света для отражения света от фильтра возбуждения на образец на монтажной площадке. Зеркало также блокирует нежелательный свет, отраженный обратно от образца на окуляр. Устройство обычно устанавливают под углом 45 o к пути света.
Покрытие зеркала обладает уникальной способностью отражать один цвет (свет, излучаемый эмиссионным фильтром) и отражать другой цвет (свет, отраженный от образца).Традиционно в этом месте использовались зеркала, однако были разработаны стекла со специальным покрытием, обеспечивающие гораздо большую эффективность пропускания и отражения.
Эмиссионный фильтр помещается между образцом и детектором. Он передает только длины волн в пределах спектра излучения флуорохрома, блокируя все другие длины волн. В зависимости от покрытия эти фильтры могут быть короткопроходными или длинными.
Длиннопроходные фильтры выбираются, когда сигнал, излучаемый флуорохромом, очень слаб.Однако, если вы исследуете образец, окрашенный несколькими флуорохромами, рекомендуется использовать короткий фильтр для уменьшения фонового шума. Характеристики оптической плотности и средней длины волны фильтра излучения должны основываться на тех же принципах, что и для фильтра возбуждения.
Тепловые фильтры , также называемые горячими зеркалами, можно размещать на пути света, чтобы блокировать инфракрасное излучение путем поглощения или интерференции. Эти устройства предотвращают повреждение флуоресцентных фильтров из-за повреждения, связанного с нагревом.
Фильтры среднего серого / Фильтры нейронной плотности: Эти фильтры равномерно уменьшают падающий свет по всему спектру. Поэтому эти устройства лучше всего использовать для регулировки экспозиции и яркости. Обычно они устанавливаются между коллектором и диафрагмой.
Поляризационные фильтры:
Фотоны в световом луче колеблются в нескольких направлениях. В поляризованном световом микроскопе используется поляризатор для фильтрации определенных колебаний.Линейный поляризатор ограничивает колебания одной линейной плоскостью, в то время как круговой поляризатор отфильтровывает две линейные плоскости, перпендикулярные друг другу, в результате чего электрическое поле образует круг.
Как использовать фильтр
Фильтр идеально расположен на пути света микроскоп. Хотя некоторые фильтры чувствительны к углу (как описано выше), другие можно разместить под любым углом.
В простейших микроскопах можно просто вырезать цветовой фильтр в форме источника освещения и поместите его на пути света.
Однако большинство составных микроскопов оснащены круглым столом для фильтров, который содержит несколько слотов для стандартных фильтров. Круглый стол откидывается чуть ниже ирисовой диафрагмы, и фильтр можно установить и повернуть обратно на место.
Чтобы вставить фильтр, вам нужно найти ирисовую диафрагму микроскопа. Если вы не знаете, где это находится, пожалуйста, эту статью, и если вы не знаете, что делает ирисовая диафрагма, и вы хотели бы получить дополнительную информацию, пожалуйста, прочтите эту статью.
Как только вы найдете ирисовую диафрагму, в нижней части, ближайшей к источнику света, вы увидите откидной отсек, который можно повернуть пальцем.
Затем поместите фильтр в прорезь для фильтра и поверните его обратно на место. Убедитесь, что вы зафиксировали его в нужном положении, и он не блокирует какую-либо часть ирисовой диафрагмы, потому что это заблокирует свет, что снизит качество вашего изображения.
Флуоресцентный микроскоп оснащен несколькими фильтрами, которые можно выбрать в зависимости от исследуемого флуорохрома.Также важно регулярно очищать фильтры сжатым воздухом, чистящими растворителями, содержащими спирт, и безворсовыми тампонами.
Сколько стоят фильтры?
- Цветные фильтры для сложных микроскопов можно купить по 45 долларов за штуку. Однако рекомендуется выбирать фильтры, предназначенные для размещения в гнездах вашего микроскопа.
- Фильтр для поляризационного микроскопа может стоить до 85 долларов, однако большинство поляризационных микроскопов поставляются с этим фильтром заранее.
- Флуоресцентные фильтры следует тщательно выбирать на основе общих флуорохромов, используемых для ваших образцов. Средний флуоресцентный фильтр может стоить до 500 долларов.
- Цену на этот набор фильтров также можно уточнить на Amazon.
вынос
Фильтры для микроскопов позволяют нам управлять светом, проходящим через микроскоп, для множества различных целей. Если у вас возникли проблемы с разрешением изображения и вы испробовали все, что могли, я бы посмотрел на фильтры и посмотрел, может ли изменение длины волны света изменить ситуацию.
Я надеюсь, что эта статья дала вам понимание не только того, как и почему вы должны использовать фильтры, но также и всех различных типов фильтров, которые используются в самых разных микроскопах для самых разных целей.
Список литературы
- https://www.edmundoptics.com/f/fluorescence-filter-sets/13971/
- https://www.olympus-lifescience.com/en/microscope-resource/primer/techniques/fluorescence/filters/
- https://www.alluxa.com/optical-filter-applications/fluorescence-filters-microscopy-imaging/
- https: // www.молекулярный.abbott/int/en/vysis-fish-knowledge-center/filter-and-microscope-basics
- https://www.microscopeworld.com/t-microscope_filter_info.aspx
Микрофотография — фильтры для цветной микрофотографии
Фотосъемка через микроскоп осложняется широким спектром неожиданных цветовых сдвигов и изменений, которые влияют на то, как изображение отображается на пленочной эмульсии или цифровом электронном устройстве захвата изображения. Эти неожиданные результаты визуализации вызваны рядом факторов, от неправильного цветового баланса между источником света и эмульсией пленки до оптических артефактов, таких как аберрация и колебания напряжения лампы.
Если разница в цветовой температуре между эмульсией пленки и источником света микроскопа тщательно контролировалась, как описано в нашем обсуждении цветовой температуры , то незначительные корректировки цветового баланса источника света микроскопа часто могут облегчить проблемы смещения цвета. В большинстве случаев причина нежелательных цветовых эффектов очень ясна или может быть легко определена путем тщательного изучения условий, в которых было произведено экспонирование. В других случаях проблема не сразу очевидна и может потребовать детального расследования, прежде чем причина будет обнаружена.
После определения основы проблемы цветной микрофотографии ее обычно очень легко исправить с помощью соответствующего использования фильтров того или иного типа. Фильтры используются для выборочного блокирования или уменьшения интенсивности выбранных длин волн при передаче всех других частей. В продаже имеется множество фильтров, помогающих фотографу-микрографу компенсировать оптические проблемы и проблемы с освещением, чтобы получить изображения максимально высокого качества. Многие изменения цвета или оттенки на микрофотографиях можно исправить, вставив соответствующий фильтр Kodak Wratten Color Compensating в оптический тракт.Также обычно используются другие фильтры, такие как нейтральная плотность, усиление контраста, поглощение ультрафиолета, поглощение тепла, инфракрасное излучение и фильтры, предназначенные для выявления деталей биологических пятен. Эти фильтры подробно обсуждаются ниже.
Экспозиция и цветовой баланс
Узнайте, как можно настроить параметры экспозиции и фильтры компенсации цвета для изменения контрастности, яркости и цветового баланса микрофотографии.
Фильтры обычно доступны в форме стекла, стекла с пластиковым покрытием, ацетатной или желатиновой основы, покрытой, смешанной или пропитанной органическими и неорганическими красителями, полученными как из природных, так и из синтетических источников.Качество стекла или полимера, используемого при производстве фильтров, имеет важное значение, оно должно быть оптического качества и обеспечивать однородность плотности и цвета по всему полю зрения микроскопа. Желатиновые фильтры являются наиболее рентабельными и оптически удовлетворительными фильтрами, доступными на рынке, что делает их предпочтительным фильтрующим материалом для критической микрофотографии, несмотря на необходимость бережного обращения. Фильтры из оптического стекла также превосходны, но они не могут удовлетворить все потребности микроскопии.Ацетатные фильтры обычно используются в системах без формирования изображения, где потребность в качестве и точности не важна. Обычно ацетатные фильтры используются в фотоувеличителях и принтерах. Фильтры с пластиковым покрытием используются в основном для безопасного освещения в темной комнате и не подходят для оптической микроскопии. Терминология, используемая различными производителями, может сбивать с толку, потому что фильтры часто обозначаются по номеру продукта или некоторым аспектам их фильтрующих свойств.Существует очень мало отраслевых стандартов для номенклатуры фильтров.
Фильтры компенсации цвета — Kodak производит серию фильтров компенсации цвета Wratten , предназначенных для широкого спектра лабораторных и промышленных применений. Эти фильтры состоят из коллоидного углерода, смешанного с подходящими красителями и диспергированного в желатине для достижения желаемых спектральных характеристик. Фильтры компенсации цвета отличаются от фильтров цветового баланса и фильтров преобразования тем, что они управляют цветом, главным образом ослабляя красные, зеленые и / или синие области спектра видимого света.Они сокращенно обозначаются префиксом CC , для C или C компенсирующий, за которым следует номинальная пиковая плотность фильтра в диапазоне от 0,025 до 0,5, умноженная на 100, и заканчивающаяся заглавной первой буквой цвета фильтра (для например M для пурпурного). Таким образом, сокращение для фильтра компенсации желтого цвета, имеющего номинальную пиковую плотность 0,3, будет: CC30Y .
Каждый фильтр в этой серии контролирует количество одного цвета, пропуская один или оба из оставшихся двух цветов.Таким образом, фильтры компенсации цвета могут вносить незначительные изменения в цветовой баланс источника света или могут компенсировать недостатки в спектральном выходе. Спектры видимого поглощения для серии фильтров с компенсацией синего цвета (от CC025B до CC50B) показаны на рисунке 2. Основные минимумы появляются в диапазоне 380–490 нанометров для всех фильтров этой серии, которые пропускают большую часть длин волн синего и фильтруют зеленый, желтый цвета. и красные длины волн при помещении на оптический путь микроскопа.
Фильтры с компенсацией цвета имеют номер (номинальная пиковая плотность), указывающий на их способность поглощать свет. Наиболее часто используются плотности 05, 10, 20, 30, 40 и 50, которые постепенно увеличивают оптическую плотность фильтра от меньшей (05) до большей (50) плотности. Например, фильтр с номером 30 снижает уровень дополнительного цвета на 50 процентов, или на один шаг экспозиции. Фильтр CC30M (пурпурный) поглощает 50 процентов проходящего через него зеленого света. Фильтры компенсации цвета можно использовать в комбинации (например, CC20Y (желтый) + CC20M (пурпурный) = CC20R (красный)), но для получения наилучших результатов следует использовать только один фильтр.Когда два фильтра комбинируются, создается немного различающийся цвет, артефакт, который может скрыть недостатки цвета на микрофотографии.
Одним из основных применений фильтров компенсации цвета является устранение различий в эмульсиях пленок внутри партии или между разными партиями. Изготовление цветной пленки — сложный процесс, который включает покрытие полимерной основы многочисленными светочувствительными эмульсиями толщиной всего несколько микрон. Колебания толщины эмульсии влияют на цветовой баланс и могут проявляться на одной или нескольких отдельных микрофотографиях, на всем рулоне пленки или в части партии.Производители допускают допуск к колебаниям, эквивалентный эффекту фильтра CC10, вариант, который, как было продемонстрировано, приемлем для большинства пользователей.
Критическая микрофотография требует, чтобы фильтры компенсации цвета использовались для тщательного контроля цветовых сдвигов, которые могут варьироваться в любом из шести основных цветов: красном, зеленом, синем, голубом, пурпурном и желтом. Чаще всего изменения партии пленки впервые проявляются при наблюдении за цветом фона на новых микрофотографиях. Этот цвет должен быть нейтральным светло-серым или белым, и изменения цвета обычно очень заметны, когда они происходят.Исправить цветовой баланс с помощью фильтров компенсации цвета очень просто, используя фильтр, дополняющий цветовой сдвиг, присутствующий в фоновом режиме. При выполнении сложной микрофотографии с использованием цветной пленки целесообразно приобрести пленку с одинаковым номером эмульсии на каждом рулоне и хранить излишки в холодильнике или морозильнике. Затем можно использовать испытательный рулон для определения переменных компенсации цвета и баланса, которые должны оставаться постоянными для остальной партии пленки. Рекомендуемая процедура состоит в том, чтобы показать один кадр без компенсационного фильтра, за которым следуют кадры, выставленные через каждый из фильтров серии CC10 (CC10R, CC10G, CC10B, CC10C, CC10M и CC10Y).После совмещения всех семи микрофотографий на световом столе 5000 K фон, отображающий чистый белый или очень светло-серый фон, будет правильно отфильтрован.
Микрофотографии, показанные на фиг. 3, демонстрируют тест с использованием фильтра для цветокоррекции с использованием микрофотографии окрашенного эозином / гематоксилином тонкого среза ткани нижней двенадцатиперстной кишки человека. На рисунке 3 (d) показан базовый цветовой баланс без добавления фильтров цветокоррекции. Общий желтый оттенок изображения предполагает, что фильтр CC10G (рис. 3 (f)) является подходящим фильтром для цветокоррекции.Фактически, фон на рисунке 3 (f) является самым чистым и чистым из всех изображений на рисунке 3 и представляет собой лучший выбор для цветокоррекции. Другие фильтры (рис. 3 (a, c, e, f, g)) создают фон на микрофотографии, напоминающий цвета компенсирующего фильтра. Размещение фильтра CC10Y на световом пути (рис. 3 (b)) только увеличивает интенсивность желтого фона.
Во многих случаях фильтры компенсации цвета низкой плотности могут эффективно использоваться для улучшения цветопередачи на тонких срезах тканей, окрашенных различными красителями.Каждый образец необходимо оценивать методом проб и ошибок, потому что чрезмерное использование цветовых компенсирующих фильтров может привести к ухудшению дополнительных цветов пятна и может сделать фон с оттенком. Обычно рекомендуется ограничивать фильтры компенсации цвета плотностью ниже CC20 при попытке использовать их для улучшения цвета пятен.
Согласно предложению John G. Delly , существуют более дешевые альтернативы фильтрам Kodak Wratten для микроскопистов с ограниченным бюджетом или в тех случаях, когда эти фильтры недоступны.Kodak также производит набор фильтров для просмотра цветной печати , который содержит набор прозрачных фильтров со значениями плотности 0,10, 0,20 и 0,40 для каждого из шести цветов (красный, зеленый, синий, голубой, пурпурный, желтый). Эти фильтры можно разместить на оптическом отверстии микроскопа, чтобы обеспечить быструю и легкую цветокоррекцию. Хотя фильтры для просмотра не производятся с такими же критическими допусками, как Wratten или фильтры для цветной печати, они часто могут быть заменены, если на их поверхности нет серьезных дефектов.Kodak также предлагает набор ацетатных фильтров для цветной печати (набор фильтров для цветной печати ), который доступен в квадратах размером 75 × 75 миллиметров и содержит достаточное количество фильтров для соответствия большинству плотностей, обеспечиваемых фильтрами Wratten.
Используйте ссылку ниже, чтобы перейти к страницам, содержащим данные для отдельных спецификаций фильтра компенсации цвета:
- Данные фильтра компенсации цвета — Спектры видимого поглощения и таблицы, содержащие длины волн основных максимумов, предоставляются для фильтров компенсации цвета серии Kodak Wratten семья.
Фильтры нейтральной плотности — В ситуациях, когда освещение микроскопа кажется слишком ярким для комфортного наблюдения и микрофотографии, интенсивность света следует уменьшить с помощью фильтров нейтральной плотности, часто называемых фильтрами ND . Эти фильтры имеют нейтральный серый цвет и предназначены для равномерного уменьшения интенсивности проходящего света по части или по всему спектру длин волн без значительного изменения цветовой температуры.Фильтры нейтральной плотности идеально подходят для контроля времени экспозиции на цветной микрофотографии без регулировки напряжения лампы. Их основное использование в оптической микроскопии — увеличение времени экспозиции в ситуациях, когда интенсивность лампы настолько велика, что минимально возможная экспозиция, допускаемая микрофотографическим оборудованием, превышает время, необходимое для правильного захвата изображения.
Есть два класса фильтров нейтральной плотности: поглощающие и отражающие, которые работают, поглощая или отражая выбранный диапазон длин волн.На рисунке 4 показаны спектры поглощения видимого света для ряда обычных фильтров нейтральной плотности. Как видно на рисунке, эти фильтры демонстрируют относительно постоянный коэффициент ослабления во всем видимом (от 400 до 700 нанометров) диапазоне света. Каждое приращение фильтра нейтральной плотности от ND-0,3 до ND-70 на Рисунке 4 имеет последовательно больший коэффициент экстинкции, что в совокупности обеспечивает однородную серию фильтров для регулировки освещенности.
Фильтры нейтральной плотности производятся с использованием желатиновых, полимерных или стеклянных подложек, которые имеют пропитанные или растворенные материалы для снижения оптической прозрачности.Фильтры Kodak Wratten Neutral Density очень популярны и изготавливаются из запатентованных тонких желатиновых пленок. Суспензию коллоидного углерода, содержащую выбранный набор органических красителей, смешивают с жидким желатином до достижения желаемой нейтральной плотности. Затем эту комбинацию наносят на поддерживающую стеклянную подложку до тех пор, пока она не образует очень тонкую пленку одинаковой толщины. После высыхания пленку снимают с подложки и для защиты покрывают лаком. Обратите внимание, что даже несмотря на то, что фильтры нейтральной плотности, компенсации цвета и другие фильтры Wratten защищены верхним слоем лака, они все же подвержены повреждениям (особенно от царапин), и с ними следует обращаться только по краям или по углам.Альтернативой является защита желатиновых фильтров Wratten, помещая их в простой металлический каркас, который также продает Kodak. Никогда не подвергайте фильтры длительному воздействию температур, превышающих 50 градусов по Цельсию. Также важно, чтобы эти фильтры не размещались слишком близко к вольфрамово-галогеновому источнику света микроскопа, чтобы избежать повреждения из-за тепла, выделяемого лампой.
Технические характеристики наиболее часто используемых фильтров нейтральной плотности перечислены в таблице 1. Каждый фильтр нейтральной плотности обозначается буквенно-цифровым кодом ND-XX , где XX — средний процент пропускаемого светом фильтром.Таким образом, фильтр ND-60 пропускает (или пропускает) 60 процентов падающего света от источника света, а фильтр ND-0,1 пропускает 0,1 процента падающего света. Оптическая плотность фильтра нейтральной плотности определяется как логарифм (основание 10) оптической плотности (обратной величины пропускания) в соответствии с уравнением:
Оптическая плотность (D) = log (A)
Где:
A (поглощение) или непрозрачность = 1 / T (пропускание)
И, следовательно:
D = log (1 / T)
Где T — процент света, проходящего через фильтр, D — это оптическая плотность, а A — оптическая плотность.Большинство микроскопистов при работе с фильтрами нейтральной плотности обращаются к плотности, а не к непрозрачности (обратному коэффициенту пропускания). Это, вероятно, более уместно, потому что человеческий глаз воспринимает разницу в интенсивности света в логарифмической шкале.
Фильтры нейтральной плотности можно складывать вместе для получения значений плотности, для которых нет фильтра. Укладка этих фильтров является аддитивной, так что размещение фильтров ND-50 (плотность = 0,3) и ND-60 (плотность = 0,2) на световом пути эквивалентно такому размещению ND-30 (плотность = 0.5) фильтр. Фильтр с плотностью 0,30 имеет коэффициент пропускания 50 процентов (ND-50, Таблица 1), поэтому его можно использовать для уменьшения интенсивности лампы микроскопа в два раза. Аналогично, фильтр с плотностью 0,6 (ND-25, Таблица 1) имеет значение пропускания 25 процентов (снижает интенсивность лампы в четыре раза), а фильтр с плотностью 1,0 (ND-2.0, Таблица 1) может уменьшите яркость лампы в 10 раз (значение коэффициента пропускания 10 процентов).
Как упоминалось ранее, регулировка экспозиции на микрофотографии является одной из основных целей использования фильтров нейтральной плотности.Многие современные микроскопы имеют мониторы экспозиции с ЖК-дисплеями, которые информируют оператора о времени экспозиции при выдержке до сотых долей секунды. Эти мониторы также обычно позволяют регулировать экспозицию с шагом от 1/3 до 1/2 диафрагмы. В некоторых случаях, особенно при использовании яркопольного освещения с помощью высокоэнергетических вольфрамово-галогенных ламп, время экспозиции, рекомендованное монитором, составляет менее 0,05 секунды. Это очень короткое время, которое может привести к неправильной экспозиции и виньетированию изображения.Добавление фильтра нейтральной плотности ND-50 к световому пути удвоит необходимое время экспозиции до 0,1 секунды, а фильтр ND-25 увеличит экспозицию до комфортных 0,2 секунды.
Характеристики фильтра нейтральной плотности
| Обозначение | Плотность | Передача (в процентах) |
|---|---|---|
| ND-80 | ||
| НД-70 | 0.15 | 70% |
| НД-60 | 0,2 | 60% |
| НД-50 | 0,3 | 0,3 |
| ND-40 | 0,4 | 40% |
| ND-30 | 0,5 | 30% | 30% | 9032 9032 0.625% |
| ND-20 | 0,7 | 20% |
| ND-16 | 0,8 | 0,8 |
| НД-13 | 0,9 | 13% |
| НД-10 | 1,0 | 10% | 10% |
| 1% | ||
| ND-0,1 | 3,0 | 0,1% |
| ND-0,01 | 4,0 9020% |
Таблица 1
Возможность регулировки экспозиции с помощью фильтров нейтральной плотности особенно важна для камер с фиксированной выдержкой (диапазон этих скоростей составляет примерно от 1/500 секунды до пары секунд), в которых каждая последовательная скорость увеличивает экспозицию на двукратное увеличение.Например, экспонометр может рекомендовать выдержку 1/1000 секунды для затвора, максимальная скорость которого ограничена до 1/250 секунды. Поместив фильтр нейтральной плотности ND-25 на световой путь, интенсивность лампы эффективно снижается в четыре раза, увеличивая рекомендуемое время экспозиции до 1/250 секунды. Чтобы добиться более удобной выдержки, используйте фильтр ND-2.0, чтобы увеличить время экспозиции до 0,1 секунды.
Фильтры нейтральной плотности также полезны для экспозиций, находящихся между двумя выдержками.В ситуации, когда выдержка 1/125 секунды слишком короткая, но 1/60 секунды слишком длинная, фильтры нейтральной плотности могут быть размещены на пути света, чтобы отрегулировать освещение, чтобы разместить экспозицию между этими двумя значениями. Фильтр ND-60, ND-70 или ND-80, используемый с выдержкой 1/125 секунды, добавит от 1/3 до 2/3 диафрагмы к времени экспозиции, обеспечивая большую свободу в экспозиции. Фактическая экспозиция должна определяться методом проб и ошибок, но фильтры нейтральной плотности должны регулярно использоваться для настройки времени экспозиции на камерах с фиксированной выдержкой.Будьте осторожны, чтобы не вводить очень длинные выдержки из-за использования фильтров нейтральной плотности, поскольку это может привести к нарушению взаимности и связанным с этим артефактам цветового баланса.
Старые фильтры нейтральной плотности с возрастом могут приобретать легкий желтоватый оттенок, а некоторые из более дешевых фильтров также имеют некоторую степень цвета фона. Если введение фильтров нейтральной плотности в оптический путь приводит к неправильному цветовому балансу для микроскопа, который был тщательно откалиброван, используйте фильтры компенсации цвета, чтобы вернуть источник света микроскопа в его надлежащий баланс.Другие оптические факторы, такие как внутреннее рассеяние и отражения, могут влиять на эффективную плотность фильтров нейтральной плотности, заставляя их отличаться от измеренной плотности. По этой причине важно откалибровать фильтры нейтральной плотности для критической микрофотографии.
Фильтры для окрашенных образцов — Тонкие срезы биологической ткани часто окрашивают одним или несколькими органическими красителями, чтобы выборочно улучшить видимость различных элементов, присутствующих в образце.Интенсивность и оттенки, создаваемые большинством пятен биологических тканей, очень хорошо воспроизводятся на цветной пленке, но некоторые пятна, как правило, выглядят размытыми или меняют свой цвет, особенно в смеси с несколькими пятнами. Во многих случаях фильтры компенсации цвета могут помочь восстановить большую часть или весь потерянный цвет, но слишком большая фильтрация может повлиять на цвет соседних окрашенных элементов и фона. Эта проблема возникает с популярными пятнами эозина, фуксина и метиленового синего, которые не очень хорошо воспроизводятся на большинстве цветных пленок.Часто ткани, окрашенные этими красителями, по отдельности или в смеси, выглядят мутными и не имеют насыщенности цвета.
Чтобы противодействовать этому эффекту, микроскописты используют дидимиевый фильтр , который содержит комбинацию редкоземельных элементов, растворенных в стекле. Дидимиевые фильтры удаляют часть оранжевой области спектра видимого света, что увеличивает интенсивность насыщенности цвета коричневых, синих и красных пятен на образце. Коэффициент экстинкции является самым высоким между 580 и 590 нанометрами для дидимиевого фильтра, что позволяет фильтру удалять большую часть оранжевого и желтого цветов, которые имеют тенденцию к тусклым красным и синим тонам на окрашенных тонких срезах.
Дидимиевые фильтры
Изучите влияние дидимиевого фильтра на цветопередачу образцов, окрашенных эозином, фуксином и метиленовым синим.
На рисунке 5 показаны две микрофотографии одного и того же образца — тонкого среза поджелудочной железы человека, окрашенного смесью эозина и гематоксилина. Микрофотография слева (рис. 5 (а)) была сделана без использования фильтров компенсации цвета или дидимиевого фильтра. Справа (рис. 5 (b)) — изображение того же поля зрения, на этот раз с дидимиевым фильтром, вставленным в световой путь.Обратите внимание на резкое увеличение насыщенности цветов для красных и синих тонов на этой микрофотографии.
Дидимиевые фильтры производятся в виде очень тонких стеклянных секций толщиной от одного до двух миллиметров, поскольку количество света, поглощаемого фильтром, зависит от толщины фильтра. Более толстые дидимиевые фильтры могут вызывать артефакты, такие как цветной фон и ухудшение других цветов пятен. Большинство крупных производителей микроскопов предлагают дидимиевый фильтр нужных размеров в качестве дополнительного аксессуара.
В некоторых случаях фон биологического образца может слегка окрашиваться во время процедуры окрашивания, что является нежелательным артефактом. Чтобы избежать этого, можно использовать фильтры компенсации цвета для вычитания цвета фона, если он не слишком насыщенный. Еще одна проблема с окрашенными тонкими срезами — это окраска монтажной среды. Канадский бальзам, популярная среда для приготовления тонких срезов, обычно становится светло-желтой с возрастом или у целых образцов. Фильтр компенсации синего цвета (CC10-20B) обычно решает эту проблему, если только образец не является очень толстым цельным держателем.В этом случае невозможно полностью нейтрализовать желтый оттенок.
Ультрафиолетовые фильтры — Вольфрамовые лампы для микроскопов не излучают значительное количество ультрафиолетового света, но некоторые из новых вольфрамово-галогенных ламп в дополнение к ртутным и ксеноновым лампам излучают значительное количество ультрафиолетового света в диапазоне 300-400 нанометров. . Ультрафиолетовое излучение может обнажить чувствительный к синему слой эмульсии во многих цветных пленках, в результате чего микрофотография в целом будет иметь синий оттенок.Это в первую очередь проблема флуоресцентной микроскопии, но она может возникать в любом микроскопе, использующем вольфрамово-галогенные, ртутные или ксеноновые лампы высокой интенсивности. Чтобы уменьшить ультрафиолетовый свет, используйте фильтры Kodak Wratten 2B или 2E , которые поглощают ультрафиолетовое излучение ниже 390 и 415 нанометров соответственно. Фильтр 2B удаляет практически все длины волн ультрафиолета, оставляя только видимый свет для освещения образца. Имея более широкий спектр заблокированных длин волн, фильтр 2E также удаляет часть фиолетового и синего света с более короткой длиной волны, поэтому этот фильтр менее желателен для цветной микрофотографии.
Эффекты ультрафиолетового света на цветной микрофотографии проиллюстрированы на Рисунке 6. Изображение слева (Рисунок 6 (a)) показывает окрашенный эозином-гематоксилином тонкий срез секретирующих слизь трубчатых желез в эпителии толстой кишки человека. На микрофотографии присутствует общий синий оттенок, который пронизывает большинство деталей образца и фон. После помещения фильтра Kodak Wratten 2B в световод микроскопа было получено изображение справа (рис. 6 (b)). Обратите внимание, что эта микрофотография демонстрирует лучшую насыщенность цвета и более чистый фон с устранением синего оттенка.
Флэш-лампы также могут излучать значительное количество ультрафиолетового света, и может потребоваться использование фильтра для удаления нежелательных длин волн. Многие современные прозрачные пленки, сбалансированные по цвету для дневного освещения, содержат маску, поглощающую ультрафиолет, в качестве одного из слоев пленки. В этом случае, вероятно, нет необходимости в использовании фильтров. Рекомендуется читать спецификации производителя на каждый новый тип пленки, чтобы убедиться, защищена ли она слоем, блокирующим ультрафиолетовое излучение.
Теплопоглощающие фильтры — Почти 90 процентов излучения, излучаемого вольфрамовой или вольфрамово-галогенной лампой, происходит в форме инфракрасных волн, что связано с выделением тепла. Ртутные и ксеноновые дуговые лампы также выделяют значительное количество тепла. На световой тракт микроскопа рядом с осветителем можно добавить теплопоглощающие фильтры для удаления нежелательных длин волн инфракрасного излучения и защиты оптических компонентов микроскопа, фильтров и образца от теплового повреждения.Фактически, большинство крупных производителей микроскопов предлагают поглощающие тепло фильтры в качестве стандартного оборудования, а некоторые даже включают эти фильтры в осветитель. Если вы подозреваете, что ваш осветитель микроскопа может иметь встроенный теплопоглощающий фильтр, обратитесь к руководству пользователя или обратитесь к дилеру прибора. Многие тепловые фильтры OEM-осветителей нелегко снять, и их следует оставить на месте.
Некоторые теплопоглощающие фильтры изготовлены из особого типа стекла Pyrex, известного как Aklo , которое поглощает инфракрасные тепловые лучи и имеет зеленый или сине-зеленый цвет.Фильтры, изготовленные с использованием Aklo, могут вносить отклонения цветового баланса на микрофотографии. Этот побочный эффект можно исправить с помощью цветовых компенсирующих фильтров, которые дополняют цвет теплопоглощающего фильтра. Если тепловой фильтр можно вынуть из корпуса лампы, сделайте это и проверьте его на световом столе 5500 К. Светло-зеленые тепловые фильтры можно компенсировать фильтром компенсации пурпурного цвета CC10M или CC20M, а сине-зеленые тепловые фильтры можно компенсировать светло-красным (CC10R или CC20R) фильтром.Поместите дополнительные фильтры на верхнюю часть теплового фильтра, пока не будет обнаружен тот, который точно уравновешивает оттенок на тепловом фильтре и делает цвет нейтральным. Когда этот компенсирующий фильтр вставлен в световой тракт микроскопа, он должен устранить проблемы с цветовым балансом. Некоторые из новых микроскопов оснащены дихроичными интерференционными фильтрами, предназначенными для отражения тепла обратно в ламповый домик. Дихроичные фильтры гораздо более эффективны в блокировании тепла, чем кварцевые или стеклянные теплопоглощающие фильтры, и не трескаются или не ломаются при поглощении значительного количества тепла.
Для того, чтобы использовать весь потенциал фильтров в цветной микрофотографии, микроскопист должен иметь полное представление о технических аспектах взаимодействия между фильтрами, видимым светом и пленочными эмульсиями. Когда фильтры применяются правильно для решения проблем смещения цвета и баланса, качество цветных микрофотографий значительно улучшается.
Соавторы
Мортимер Абрамовиц — Olympus America, Inc., Драйв двух корпоративных центров., Melville, New York, 11747.
Майкл У. Дэвидсон — Национальная лаборатория сильных магнитных полей, 1800 Ист. Пол Дирак, доктор, Университет штата Флорида, Таллахасси, Флорида, 32310.
Фильтры для микроскопии | Зеркала для микроскопии
Микроскопия — широко используемый метод для просмотра и визуализации объектов, которые не могут быть обнаружены невооруженным глазом. Существует много типов микроскопов, каждый из которых использует свою стратегию для разрешения деталей, которые в противном случае остались бы скрытыми.
Самый распространенный микроскоп — это световой микроскоп, который можно найти почти в каждой средней школе или университетской биологической лаборатории. Световые микроскопы используют проходящий или отраженный свет для определения интересующих особенностей образца и создания контраста.
В категории световой микроскопии существует множество методов, которые используют преимущества различных физико-оптических свойств образца для создания или усиления контраста. Некоторые из обычно используемых свойств: поглощение света, коэффициент отражения, двулучепреломление образца, дифракция и рассеяние.
Все эти методы основаны на оптических характеристиках, присущих образцу, и предоставляют исследователям пространственную и структурную информацию на протяжении многих десятилетий; однако появление флуоресцентной микроскопии открыло дверь для ответов на вопросы, на которые ранее невозможно было ответить с помощью этих других методов.
Флуоресцентная микроскопия
Соединения, которые поглощают падающий свет с определенной длиной волны и повторно излучают свет с (обычно) большей длиной волны, называются фотолюминесцентными соединениями.В зависимости от времени, в течение которого сохраняется излучение света, поглощающая молекула называется либо фосфоресцентной, когда излучение может длиться секунды (или дольше) после удаления входящего источника света, либо флуоресцентной, когда излучение прекращается практически сразу после удаления источник света.
Сила флуоресцентной микроскопии заключается не только в ее способности генерировать высокий уровень контраста за счет излучения обнаруживаемых фотонов, но и в специфичности метода.Флуоресцирующие соединения могут быть связаны с высокоспецифичными зондами, такими как антитела или короткие пептидные последовательности, для нацеливания на конкретную клеточную структуру, белок или интересующую последовательность нуклеиновой кислоты. Достижения в технологии флуорохромов привели к разработке соединений, которые можно использовать для отслеживания изменений внутриклеточных ионов и pH, состояния поляризации мембраны. С открытием, выделением и клонированием флуоресцентных белков появилась возможность контролировать клеточные процессы в живых клетках, не вводя экспериментальных артефактов из-за присутствия чужеродного зонда.
Из-за необходимости в сильном источнике света для инициирования флуоресценции (обычно ртутная или ксеноновая дуговая лампа, светодиод или лазер) к системной оптике требуется эффективное подведение этого света к образцу, одновременно устраняя его из путь обнаружения. Флуоресцентные соединения излучают фотоны на уровнях, приближающихся к 10-5 или 10-6 уровням источника света возбуждения!
Чтобы не допустить попадания возбуждающего света на наблюдателя или детектор, необходимы наборы фильтров высокого качества.Обычно они состоят из фильтра возбуждения, выбирающего диапазон длин волн возбуждения, дихроичного зеркала и фильтра излучения, блокирующего свет возбуждения. Большинство флуоресцентных микроскопов работают в режиме эпи-освещения (освещение и обнаружение с одной стороны образца) для дальнейшего уменьшения количества возбуждающего света, попадающего в детектор.
Фильтр возбуждения имеет полосовую конструкцию, которая пропускает волны желаемой длины и отражает или поглощает нежелательные длины волн.Отфильтрованный возбуждающий свет отражается от дихроичного зеркала, расположенного под углом 45 °, и возбуждает флуорофор. Зеркало обладает уникальной способностью отражать более 90 процентов света в полосе отражения, пропуская более 90 процентов света в области пропускания. Это направляет возбуждающий свет и флуоресцентное излучение соответствующим образом в оптической установке. После возбуждения флуорофор испускает излучение с большей длиной волны, которое проходит через дихроичное зеркало и эмиссионный фильтр в детектор.
Эмиссионный фильтр блокирует весь возбуждающий свет и пропускает желаемую флуоресценцию для получения качественного изображения с высоким отношением сигнал / шум.
Использование флуоресцентного детектирования в биологических и физических науках стало одним из наиболее важных средств визуализации, анализа и количественной оценки структур и функций материалов и организмов, составляющих окружающий нас мир.
С 1969 года Omega находится в авангарде разработки фильтров для обнаружения флуоресценции, от приложений визуализации в микроскопии до захвата сигналов в биолюминесцентных анализах, мы разработали и изготовили широкий выбор флуорофорных и специализированных фильтров и наборов фильтров для использования в отдельных и системы с несколькими этикетками.
Мы применяем ряд технологий нанесения покрытий для достижения самого широкого предложения продуктов для обнаружения флуоресценции на рынке. Наши продукты оптимизированы для обеспечения высокого уровня сигнала и низкого фона, обеспечивая отличные значения контрастности в приложениях для обработки изображений и без них.
Мы стремимся продвигать обнаружение флуоресценции посредством сотрудничества с учеными и промышленностью по всему миру.
Наборы фильтров, компоненты и держатели доступны для всех основных производителей и моделей микроскопов, включая Leica, Nikon, Olympus и Zeiss.
Фильтры
Введение
Световой микроскоп остается одним из наиболее часто используемых инструментов для исследований, особенно в областях биологических или биофизических наук, и предлагает средства для наблюдения за динамикой клеточных процессов. Важным компонентом этих методов является получение наилучшего возможного представления образца , при одновременном минимизации повреждения образца, артефактов, и неопределенности .
Свет состоит из непрерывного спектра многих длин волн, представляющих различных цветов . Часто включение несоответствующего широкого диапазона длин волн во время экспериментов по визуализации может привести к различным проблемам, таким как артефакты, перекрестные помехи, просачивание, повреждение / фототоксичность образца и низкий контраст изображения, но слишком узкий диапазон может привести к низкой интенсивности сигнала.
Чтобы предотвратить это, важно, чтобы выборочно отфильтровывал определенные длины волн света. и пропускали другие , чтобы повысить качество получаемого изображения, а также минимизировать нежелательное повреждение образца.Без фильтров детектор не смог бы отличить флуоресцентное излучение от возбуждающего света и автофлуоресценцию в образце. Следовательно, определение того, какие фильтры необходимы и как они должны быть настроены и введены в световой путь, является важным компонентом получения высококачественных изображений.
В этой статье будут представлены и подробно обсуждены различные фильтры, чтобы проинформировать пользователей микроскопов о типах доступных фильтров и о том, как правильно определить нужный им фильтр.
Зачем нужны фильтры в микроскопии?
Фильтры для микроскопии изменяют свет в оптической системе визуализации. Это может быть для целей наблюдения или для получения высококачественных изображений с помощью детектора.
Каждый фильтр для микроскопии может служить различных целей , и фильтры можно использовать для различных улучшений, таких как:
- Повышение контрастности
- Блокировка окружающего света
- Удаление вредных УФ- или ИК-лучей
- Выборочное пропускание или пропускание определенных длин волн света (например, возбуждающего света)
- Исправление проблем с прохождением света
- Снижение интенсивности света.
Фильтры вставляются в световой путь в различных точках в зависимости от их функции . Одним из наиболее распространенных применений фильтров в приложениях флуоресцентной визуализации является разделение различных длин волн света для селективного возбуждения определенных флуорофоров и последующее разделение испускаемого и возбуждающего света для получения высококонтрастных изображений. В правильно сконфигурированном микроскопе только испускаемый свет должен достигать детектора, так что получаемые флуоресцентные структуры имеют высокий контраст на очень темном или черном фоне.Для этого необходима правильная фильтрация.
Фильтрующие механизмы
Фильтры — это оптических компонентов , которые пропускают определенные длины волн света, ослабляя или блокируя другие. Уровень затухания фильтров описывается в оптической плотности из-за множества различных методов, доступных для блокировки света. Различные используемые методы зависят от типа фильтров, из которых существует три основных типа: поглощающий , помеховой и акустический .
Поглощение
Фильтры на основе абсорбции обычно состоят из цветного стекла , которое избирательно поглощает длины волн света и передает энергию в тепло.
Это относительно недорогих , стабильных и долгоживущих при нормальных условиях. Эти фильтры обычно изготавливаются из цветного стекла или желатина, помещенного между двумя стеклянными пластинами. Однако они обычно ограничиваются небольшим выбором цветов , они предлагают низкий пиковый коэффициент пропускания и небольшую гибкость в доступной толщине.Процесс поглощения также преобразует лучистую энергию в тепла , что может привести к растрескиванию стекла при интенсивном освещении.
Помехи
Фильтры на основе помех состоят из нескольких тщательно спроектированных слоев , которые избирательно передают длины волн на основе эффектов интерференции, возникающих между падающей и отраженной волнами на границах слоев.
Большинство оптических фильтров представляют собой интерференционные фильтры , которые основаны на принципе интерферометра Фабри-Перо (или эталона ).Эти многослойные устройства изготовлены из микроскопически тонких слоев материала, состоящего из различных типов стекла или плавленого кварца, каждое из которых имеет две отражающие поверхности или зеркала. Пиковая длина волны передачи соответствует резонансу эталона ( Рис.1 ). Несколько эталонных слоев с разной длиной оптического пути включены для передачи более широкого диапазона длин волн, а ширина полосы фильтра определяется количеством этих слоев. Использование интерференционных фильтров в микроскопии значительно расширилось из-за высокого уровня селективности и пропускания по сравнению со стеклянными аналогами.
Рисунок 1: Принцип действия интерференционных фильтров (на основе эталона). Свет входит в эталон (черный) и проходит через множество отражений / преломлений / пропускания в зависимости от цвета (синий и красный), интерференция света, выходящего из эталона во время каждого отражения, вызывает модуляцию в проходящем и отраженном лучах.Акустический
Акустические фильтры состоят из двулучепреломляющего кристалла ; применение колеблющейся радиочастоты (RF) изменяет показатель преломления и, следовательно, дифракционные свойства кристалла.Изменение RF изменяет длину волны дифрагированного света, что позволяет быстро настраивать длину волны .
Фильтры на основе акустики, также известные как фильтры с перестраиваемой акустической оптикой (AOTF) . Обычно они ограничиваются хорошо сколлимированными источниками света.Некоторые ограничения существуют с AOTF, включая их неспособность работать с длинами волн менее 450 нм и , а также то, что тепловые эффекты могут изменять показатель преломления кристалла до тех пор, пока не будет достигнута стабильность.
Типы фильтров
Три наиболее распространенных типа фильтров, используемых для выбора цвета во флуоресцентной микроскопии: фильтры возбуждения , барьерные фильтры и дихроичные светоделители . В современных микроскопах это обычно интерференционные фильтры.
- Фильтры возбуждения позволяют пропускать свет определенных длин волн (длины волн возбуждения) на пути к образцу.
- Барьерные / эмиссионные фильтры ослабляют длины волн возбуждения и пропускают только выбранные длины волн эмиссии в направлении глаза или детектора.
- Дихроичные зеркала — это специализированные фильтры, которые состоят из тонкого куска материала с покрытием (часто кварцевого стекла УФ-класса), установленного под углом 45 °.Этот материал с покрытием разработан, чтобы эффективно отражать длины волн возбуждения и передавать длины волн излучения с эффективностью до 95%.
Фильтры также обычно могут пропускать только коротких волн , длинных волн или полосу между длинными и короткими волнами, и они называются и определяются следующим образом:
- Длинный проход (LP) фильтры пропускают длины волн, превышающие определенную длину волны, описываемую длиной волны при 50% пикового пропускания.
- Короткопроходные (SP) фильтры пропускают длины волн ниже определенной длины волны
- Полосовые фильтры (BP) пропускают световые длины волн между двумя разными длинами волн, давая полосу передаваемых длин волн.
Фильтры LP, SP и BP описаны далее в Рис. 2 .
Рисунок 2: Графики изменения коэффициента пропускания в зависимости от длины волны для фильтров SP, LP и BP. Проходящий свет отображается яркими цветами, а ослабленный свет — тусклым.Для SP-фильтра передаются более короткие длины волн, в то время как свет с более длинными волнами блокируется, и наоборот для LP-фильтров. В фильтрах BP комбинация характеристик фильтра SP и LP пропускает только полосу длин волн света, такую как зеленый свет в этом примере. Наклон фильтра — это градиент кривой между переданной и заблокированной длинами волн. Это заставляет SP передавать синий / зеленый, LP передавать желтый / красный, а BP передавать любой диапазон, но обычно зеленый.Хотя исторически использовались фильтры SP и LP, большинство современных фильтров являются фильтрами BP из-за дополнительного контроля длины волны.Большинство флуорофоров в флуоресцентной микроскопии имеют очень четко определенные полосы профилей возбуждения и испускания, поэтому фильтры BP очень хорошо подходят для избирательного пропускания возбуждающего света и испускаемого света для улучшения генерации и сбора сигналов.
Наборы фильтров
Распространенная проблема с фильтрами — это знать, как ориентировать их на световом пути. Для упрощения и простоты использования фильтры обычно согласованы и объединены для создания куба фильтра ( рис.3 ). Кубики фильтров , таким образом, состоят из фильтра возбуждения , дихроичного и барьерного фильтра , правильно ориентированных для обеспечения флуоресцентной визуализации определенных длин волн света, одновременно удаляя любые помехи или артефакты от других источников, таких как как свет возбуждения.
Наборы оптических фильтров , которые используются для регистрации флуоресценции, разработаны для основных длин волн, используемых в приложениях флуоресценции, которые основаны на наиболее часто используемых флуорофорах .По этой причине кубики часто называют в честь флуорофора, для визуализации которого они предназначены, например, DAPI (синий), FITC (зеленый) или TRITC (красный) фильтрующих кубиков. Эти кубики фильтров помещаются на световом пути и избирательно фильтруют свет, обеспечивая высококонтрастное флуоресцентное изображение. Фильтры внутри фильтрующих кубиков разных производителей чаще всего не взаимозаменяемы.
Рисунок 3: Пример куба фильтра и то, как свет взаимодействует с различными компонентами.Белый свет попадает в куб фильтра на фильтре возбуждения (синий), который избирательно пропускает длины волн, необходимые для возбуждения интересующего флуорофора. Затем прошедший свет взаимодействует с дихроичным (желтым) светом, где он с высокой эффективностью отражается в сторону образца. Флуорофоры возбуждаются и излучают характерную длину волны, которая длиннее, чем у возбуждающего света, и вместе с отраженным возбуждающим светом возвращается обратно в фильтрующий куб. Теперь дихроичный свет отражает обратно рассеянный свет от детектора, в то время как пропускает более длинноволновый эмиссионный свет.Затем свет снова фильтруется с помощью эмиссионного фильтра (красный) перед обнаружением.Во время флуоресцентного сбора данных, свет с определенной длиной волны генерируется путем прохождения мультиспектрального света от источника света через фильтр возбуждения, выборочно пропуская желаемые длины волн возбуждения. Длины волн, которые проходят через фильтр возбуждения, затем отражаются от поверхности дихроичного зеркала, которое наклонено под углом 45 ° к свету возбуждения, через линзу объектива к образцу, возбуждая флуорофоры, спектр возбуждения которых коррелирует с длиной волны свет.
После возбуждения флуорофоры будут излучать свет с большей длиной волны по сравнению со светом возбуждения, этот свет излучения собирается линзой объектива и возвращается обратно к дихроичному зеркалу, где он может проходить (из-за большей длины волны). Нежелательный рассеянный свет возбуждения отражается в сторону источника света. Излучаемый свет перед попаданием в детектор затем фильтруется эмиссионным фильтром, который удаляет любой остаточный нежелательный свет (например, автофлуоресценцию).
Эти высокоэффективные наборы фильтров обеспечивают максимальное ослабление возбуждающего света на пути обнаружения параллельно с успешным захватом как можно большего количества излучаемых фотонов. Высокая эффективность обнаружения позволяет соответствующим образом снизить уровень освещенности и, таким образом, снизить фототоксичность для образца.
Пример спектральной диаграммы куба фильтра Alexa Fluor 488 показан на Рис.4 . Показаны спектры возбуждения и испускания Alexa Fluor 488, а также показаны соответствующие фильтры возбуждения, испускания и дихроичные фильтры, специально подобранные для визуализации этого флуорофора.
Рисунок 4: Спектральная диаграмма возбуждающих, дихроичных и эмиссионных фильтров в фильтрующем кубе, предназначенном для изображения красителя Alexa Fluor 488. График, показывающий спектры возбуждения (зеленая черта) и излучения (зеленый) Alexa Fluor 488. Длины волн пропускания показаны полосовой фильтр возбуждения (синий), дихроичный (оранжевый) и полосовой фильтр излучения (зеленый). Адаптировано из Spectraviewer ThermoFisher.Помимо отдельных наборов фильтров , доступны также двухканальных фильтров и трехдиапазонных фильтров , которые позволяют одновременно получать изображения с нескольких флуорофоров.Например, комбинация фильтров DAPI-FITC-TRITC позволяет одновременно обнаруживать те или иные флуорофоры, имеющие схожие спектральные характеристики. Однако необходимо следить за тем, чтобы возбуждение любого включенного флуорофора как можно меньше перекрывалось с диапазоном длин волн передаваемого излучения другого — это привело бы к так называемой «перекрестной помехе », когда возбуждающий свет непреднамеренно достигает детектора.
Именование фильтров
Существует множество необычных условных обозначений для имен фильтров, которые могут сбивать с толку.Точно так же многие производители применяют свою собственную номенклатуру. Как уже упоминалось, тремя основными классами являются фильтров возбуждения , фильтров излучения / барьера и дихроичных фильтров , но фильтры также можно разделить на категории SP, LP или BP. Обычно фильтры обозначаются этими характеристиками и длиной волны , где они переключаются между передачей и отражением .
Идентификационные данные различных типов фильтров и их номенклатура следующие:
- Фильтры возбуждения : можно использовать Ex или X .Фильтры возбуждения включают синее стекло (BG), или ультрафиолетовое стекло (UG)
- Эмиссионные / барьерные фильтры : можно использовать BA или M . Эмиссионные / барьерные фильтры включают желтое стекло ( Y или GG ) или красное стекло ( R или RG ).
- Фильтры Dichroic : могут также называться светоделители (BS), хроматические светоделители (CBS), дихроичные зеркала (DM), teiler kante ( TK , немецкий язык для разделения кромок), farb teiler ( FB) , немецкий для цветоделителя) или коэффициент отражения, короткий проход ( RKP )
Кроме того, чтобы различать короткие, длинные и полосовые фильтры, фильтры имеют обозначение SP (или KP из канте. , немецкое слово для edge ), LP (или L ) и BP (или B ) соответственно.
Часто имена фильтров включают чисел тоже. Как наиболее распространенная единица для описания фильтров с длиной волны нм в нм, она используется для описания свойств фильтров. Для фильтра BP используется центральная длина волны ( CWL ) при 50% пикового пропускания, за которой часто следует полоса пропускания. Для LP-фильтра используемое число будет длиной волны среза. Для SP-фильтра это будет длина волны «отсечки», то есть точка, в которой фильтр переключается с передачи на отражение и передает 50% пиковой передачи.
В качестве примера: гипотетический фильтр BP представляет собой комбинацию короткого прохода ( 550 нм, ) и длинного прохода ( 500 нм ), который по отдельности будет обозначен как SP550 и LP500 , но при описании комбинация фильтров BP, она будет обозначена как BP 525d25 . Это указывает на полосу пропускания с центром на 525 нм с разрешенной передачей 25 нм с любой стороны.
Другие типы фильтров
Существуют и другие типы фильтров для микроскопии.В следующем списке указаны их названия и способы использования:
- Фильтры нейтральной плотности (ND) : используются для уменьшения интенсивности освещающего света в широком спектре без изменения диапазона доступных длин волн. Они имеют постоянное затухание в диапазоне видимых длин волн и, таким образом, снижают интенсивность света за счет отражения или поглощения. Фильтры ND доступны в различных плотностях и материалах и могут быть сложены друг над другом для увеличения оптической плотности и значительного ослабления интенсивности света.
- Клиновые фильтры : толщина изменяется непрерывно или ступенчато через фильтр в форме клина. Они также известны как линейно-регулируемые фильтры (LVF) . Он используется для таких приложений, как гиперспектральные датчики .
- Поляризационные фильтры : поляризуют свет линейно или по кругу. Это может быть использовано для микроскопии в поляризованном свете , который является методом без меток для исследования двулучепреломляющих (двойное преломление) анизотропных материалов.
- Инфракрасные (ИК или тепловые) фильтры : выборочно блокируют или пропускают ИК-свет. Многие ИК-фильтры используются для предотвращения нежелательного нагрева из-за ИК-излучения. Корпуса с осветительными лампами часто включают фильтр подавления инфракрасного света. Визуализация в ближнем инфракрасном диапазоне (NIR) эффективна, поскольку пропускание через ткани выше на более длинных волнах, что идеально для таких приложений, как визуализация мелких животных. Для этого типа изображения доступны наборы NIR-фильтров.
- Ультрафиолетовые (УФ) фильтры : избирательно блокируют или пропускают УФ-свет.Создание фильтров для УФ-области электромагнитного спектра является сложной задачей, но новые покрытия с использованием технологии ионно-лучевого распыления с использованием недавно разработанных покрытий теперь предлагают фильтры для диапазона 250–320 нм.
- Дидимиевые фильтры : изготовлены из стекла дидимия для увеличения интенсивности и насыщенности красных объектов . Это помогает предотвратить проблему вымывания, которую оставляют цветные пятна. Их часто используют с гистопатологическим окрашиванием для усиления красителей, таких как эозин , фуксин, и метиленовый синий .
- Желтые фильтры : точная настройка цветового баланса вольфрамовых и галогеновых источников света микроскопа для цветной микрофотографии . Желтый фильтр также может быть полезен для металлургической микроскопии для выявления дефектов в металлических конструкциях.
- Матовые стеклянные фильтры : помещаются над осветителем для получения более равномерного и рассеянного света. Они часто используются с вольфрамовыми источниками света .
Резюме
Современный микроскоп является центральным инструментом научных исследований, и много усилий направлено на максимальное использование информации, полученной в результате микроскопических экспериментов. Важнейшей частью микроскопии является обеспечение того, чтобы образец получал правильный освещающий свет, чтобы гарантировать эффективное возбуждение флуорофора и испускание наибольшего количества фотонов. Не только это, но и обеспечение того, чтобы как можно больше этих фотографий было снято с максимальной эффективностью, одновременно удаляя нежелательный свет и минимизируя экспозицию образца, тем самым ограничивая разрушение флуорофора.
Фильтры обеспечивают средства эффективной фильтрации света, проходящего через систему, в основном в виде кубиков флуоресцентных фильтров . Эти кубики специально разработаны для одного или нескольких интересующих флуорофоров и являются важным компонентом высококачественной флуоресцентной визуализации. Обеспечение правильных комбинаций фильтров, включенных в систему (и правильного места ), может обеспечить максимальное качество изображения и минимизировать повреждение образца .Точно так же в микроскопы часто включаются фильтры других типов в зависимости от конкретных индивидуальных потребностей. Они могут включать в себя светоделители, позволяющие получать изображения с несколькими длинами волн одновременно, поляризационные фильтры, разрешающие микроскопию в поляризованном свете, нейтральные фильтры, снижающие интенсивность многоспектрального света, фильтры для удаления вредных инфракрасных или УФ-лучей, а также другие фильтры, используемые для повышения качества изображения, такие как дидимиевые фильтры. и желтые фильтры.
Флуоресцентные фильтры для микроскопии и визуализации
Наборы флуоресцентных фильтров
Для нормальной работы эпифлуоресцентных и других стандартных флуоресцентных микроскопов требуются три типа оптических фильтров: (1) фильтр возбуждения, (2) фильтр излучения и (3) дихроичный светоделитель (рисунки 1 и 4).Фильтры возбуждения и излучения представляют собой полосовые фильтры, которые пропускают диапазон длин волн, который соответствует соответствующему спектру поглощения или излучения флуорофора, при этом блокируя посторонний свет с обеих сторон. Однако, если требуется яркость изображения по сравнению с контрастом, фильтры излучения также могут быть краевыми фильтрами с длинным проходом, которые пропускают более длинные волны, а не блокируют их. Большинство дихроичных светоделителей представляют собой длинные фильтры, предназначенные для использования при угле падения 45 ° (AOI). Дихроичные фильтры направляют отфильтрованный возбуждающий свет к образцу, а излучаемый свет от образца через эмиссионный фильтр к детектору (рис. 1).
Рис. 4. Набор флуоресцентных фильтров, предназначенный для использования с FITC.
Наборы флуоресцентных фильтров могут быть одно- или многополосными и могут существовать в нескольких конфигурациях, наиболее распространенными из которых являются кубики флуоресцентных фильтров и колесики фильтров. Наборы однополосных фильтров можно использовать для просмотра образцов, помеченных более чем одним флуорофором, путем получения серии изображений с каждым соответствующим кубом фильтра и последующего создания окончательного составного изображения. Этого также можно добиться с помощью конфигураций колеса фильтров Pinkel или Sedat.Наборы фильтров Пинкеля состоят из многополосного фильтра излучения и полихроичного фильтра, которые используются вместе с несколькими однополосными фильтрами возбуждения. Наборы фильтров Sedat состоят из полихроичного фильтра, который используется вместе с несколькими однодиапазонными фильтрами возбуждения и излучения.
Также доступны полнополосные наборы фильтров, состоящие из многополосного фильтра возбуждения, многополосного фильтра излучения и полихроичного фильтра, которые будут создавать одно изображение, содержащее все флуоресцентные метки.
Требования к набору флуоресцентных фильтров
Для создания набора флуоресцентных фильтров, который дает высококачественное изображение с черным фоном и высокой контрастностью, фильтры возбуждения и излучения должны обеспечивать высокую пропускную способность с минимальной пульсацией полосы пропускания в областях, соответствующих пиковому возбуждению или испусканию флуорофора, и их соответствующим полосам пропускания. должны быть разделены так, чтобы перекрытия не возникали выше уровня OD7 (-70 дБ или 0,00001% передачи) (рисунок 5).Однако кроссовер OD6 (передача -60 дБ или 0,0001%) или OD5 (передача -50 дБ или 0,001%) приемлем при использовании флуорофора с очень коротким стоксовым сдвигом или в случае некоторых наборов многополосных фильтров.
Рис. 5. График набора высокоэффективных флуоресцентных фильтров. Характеристики, предназначенные для придания высокой контрастности и черного фона, выделяются.
Для достижения кроссовера OD7 флуоресцентные фильтры должны быть указаны и разработаны в виде набора.Фильтры возбуждения и излучения также должны быть спроектированы с крутыми краями, которые переходят от блокировки OD6 к пропусканию более 90% всего за несколько нанометров, чтобы позволить полосам пропускания захватывать соответствующие пики флуорофоров. Большинство наборов флуоресцентных фильтров спроектировано таким образом, что теоретические трассы фильтров возбуждения и излучения выходят за пределы OD7 для учета производственных допусков. Поскольку измеренные спектры фильтров с покрытием могут отклоняться от теории, также важно определить эти фильтры таким образом, чтобы обеспечить соответствующий кроссовер.Примерами этого могут быть определение относительно жесткого допуска по центральной длине волны или определение абсолютного диапазона передачи или блокировки вместо среднего.
Для получения черного фона фильтры возбуждения и излучения должны быть спроектированы так, чтобы блокировать любой посторонний свет. Это достигается за счет задания широких диапазонов внеполосной блокировки на уровне OD6 или выше. Для систем, в которых используются широкополосные источники света, требуются диапазоны блокировки от ~ 300 до ~ 1100 нм вне полосы, в то время как для переключаемых светодиодных источников света требуется внеполосная блокировка от ~ 300 до ~ 850 нм.Фильтры излучения для лазерных систем требуют, по крайней мере, абсолютной блокировки OD6 на лазерной линии, в то время как диапазоны блокировки вне полосы могут быть аналогичны фильтрам излучения для светодиодных источников света. Если окружающий свет не является проблемой, тогда фильтры возбуждения для лазерных систем могут не требовать блокировки в широком диапазоне за пределами полосы пропускания фильтра излучения.
Дихроичные фильтры также должны иметь относительно крутой переход между полосами отражения и пропускания, чтобы обрезанный край располагался между полосами пропускания фильтров возбуждения и излучения.Кроме того, все фильтры, пропускающие свет к детектору или окуляру, должны иметь низкую ошибку переданного волнового фронта (TWE), чтобы избежать искажения изображения.
Дихроичная плоскостность
Плоскостность поверхности дихроичного светоделителя — это свойство, которое следует учитывать при выборе набора флуоресцентных фильтров для лазера, визуализации, флуоресценции полного внутреннего отражения (TIRF) и систем сверхвысокого разрешения. Когда тонкопленочное покрытие наносится на субстрат, напряжение покрытия заставляет субстрат изгибаться, в результате чего получается чашеобразная или куполообразная кривизна (рис. 6).Эта кривизна, вызванная напряжением покрытия, вызывает повышенную ошибку отраженного волнового фронта (RWE), что может привести к смещению фокуса и искажению размера пятна в этих системах. Следовательно, необходимо покрытие с низким напряжением (рис. 7) или компенсация обратной стороны, чтобы избежать деформации.
Рис. 6. Интерферограмма, показывающая кривизну, вызванную напряжением покрытия, которое может привести к искажению изображения.
Рис. 7. Интерферограмма, показывающая плоский дихроичный фильтр с низким напряжением покрытия.
Однако сложные требования к плоскостности поверхности обычно не требуются для стандартных широкопольных эпифлуоресцентных микроскопов, оборудованных широкополосной лампой или светодиодным источником света. Большинство этих систем сконфигурировано так, что дихроичный свет передает излучение на детектор, поэтому TWE необходимо контролировать, но плоскостность поверхности вряд ли повлияет на качество окончательного изображения.
Сдвиг нулевого пикселя
Флуоресцентные фильтры должны быть указаны для получения нулевого сдвига пикселей, когда они используются в любой конфигурации, где фильтры будут отключены для изображения нескольких флуорофоров в одном образце.Эти конфигурации включают наборы одноканальных фильтров, наборы Пинкеля и наборы Sedat. Эмиссионные фильтры и дихроичные фильтры, используемые в этих конфигурациях, должны быть получены от одного производителя и иметь высокую степень параллелизма, чтобы минимизировать отклонение луча, вызванное углом клина. Поскольку большинство фильтров не идеально параллельны, и поскольку напряжение покрытия приводит к определенному уровню отклонения луча, между изображениями, снятыми до и после введения в систему оптических фильтров, будет происходить некоторый сдвиг пикселей.Однако при сравнении изображений, снятых с наборами с нулевым сдвигом пикселей, которые были разработаны для совместной работы, сдвиг должен быть менее примерно ± 1 пиксель.
Минимизация перекрестных помех флуорофора
Важно минимизировать перекрестные помехи между флуорофорами при использовании многополосных наборов и наборов Пинкеля для изображений образцов, помеченных несколькими флуорофорами. Минимизация перекрестных помех также является важным фактором для флуоресцентной гибридизации in situ (FISH), FRET и проточной цитометрии.Перекрестные помехи, или просачивание, возникают, когда сигналы возбуждения и излучения одного флуорофора передаются через канал фильтра, зарезервированный для другого флуорофора, что приводит к смешению цветов в одном месте, которое имитирует эффект совместной локализации. Хотя определенное количество перекрестных помех неизбежно, важно выбрать флуорофоры и наборы фильтров, которые минимизируют этот эффект. Этого можно достичь, избегая комбинаций флуорофоров, у которых есть большое перекрытие между их соответствующими спектрами излучения.Также следует избегать перекрытия между спектрами поглощения в тех случаях, когда каждый флуорофор возбуждается другим светом светодиода или лазера. Независимо от выбора флуорофора фильтры возбуждения и испускания должны быть разработаны с относительно узкими полосами пропускания, которые улавливают пиковое возбуждение или испускание целевого флуорофора, при этом блокируя как можно больше перекрытий (рис. 8).
Рис. 8. Пример многополосного эмиссионного фильтра, который был разработан для минимизации перекрестных помех между флуорофорами.Обратите внимание, что перекрестные помехи во втором канале неизбежны из-за перекрытия спектров излучения между CFP и TurboYFP.
Минимизация GDD
Нелинейные оптические системы (NLO), в которых для возбуждения используется импульсный фемтосекундный лазер, требуют оптики, которая управляет фазовым сдвигом и дисперсией групповой задержки (GDD). В этих приборах импульсный луч проходит через несколько различных оптических компонентов или отражается от них, прежде чем в конечном итоге достигнет образца. Если эти оптические фильтры и зеркала не предназначены специально для использования с фемтосекундными лазерами, пиковая интенсивность импульса будет уменьшаться из-за GDD каждый раз, когда последовательность импульсов отражается или проходит (рисунок 9).Поскольку уменьшение пиковой интенсивности импульса приведет к уменьшению количества сигналов NLO, этот комбинированный эффект в конечном итоге приведет к плохой работе прибора.
Рис. 9. Диаграмма, иллюстрирующая влияние дисперсии групповой задержки (GDD).
Дихроичные фильтры и зеркала с контролируемой дисперсией позволяют одновременно управлять фазой и амплитудой лазерного излучения (рис. 10), что приводит к минимальной дисперсии и минимальным потерям пиковой интенсивности импульса.
Рисунок 10. Зеркало с высоким коэффициентом отражения, предназначенное для управления GDD в большом диапазоне длин волн.
Почему Аллуса?
Флуоресцентные фильтрыAlluxa имеют твердое покрытие с использованием инновационного процесса плазменного осаждения SIRRUS. Этот процесс позволяет нам производить высокоэффективные фильтры возбуждения, излучения и дихроичные фильтры с крутыми краями, пропусканием, обычно превышающим 95%, точным контролем длины волны, глубокой блокировкой и низким TWE, которые также определены для получения нулевого сдвига пикселей.
Наши дихроичные светоделители для лазера, обработки изображений, TIRF и приложений со сверхвысоким разрешением могут достигать уровней плоскостности λ / 2 PV на дюйм или лучше на подложках толщиной 1,05 мм и уровней λ / 10 PV на дюйм или лучше на более толстых подложках. . Мы также предлагаем зеркала с высоким коэффициентом отражения и дихроичные фильтры, которые контролируют GDD в широком диапазоне длин волн.
Независимо от того, разрабатываете ли вы систему флуоресценции OEM или собираетесь приобрести фильтр-куб, наши опытные инженеры будут работать с вами, чтобы разработать флуоресцентные фильтры, которые наилучшим образом соответствуют вашим конкретным требованиям.
Alluxa
Alluxa разрабатывает и производит высококачественные тонкие оптические пленки, которые используются в различных областях. На все тонкопленочные оптические фильтры и зеркала Alluxa нанесено твердое покрытие с использованием запатентованного процесса плазменного напыления на оборудовании, которое было разработано и изготовлено нашей командой. Это позволяет нам надежно и многократно производить одни и те же высококачественные тонкие оптические пленки в течение нескольких различных циклов нанесения покрытия, что обеспечивает стабильную производительность во всех ваших системах.
Свяжитесь с Alluxa для получения дополнительной информации по адресу [email protected]
или посетите наш веб-сайт http://www.alluxa.com
Авторские права на все материалы © 2018 Alluxa
Nikon | Продукты и решения для здравоохранения (решения для микроскопов)
При выборе люминесцентных фильтров и зеркал необходимо соблюдать следующие шаги.
Флуорофор (флуоресцентное вещество) длина волны
Определите длину волны используемого флуорофора. Эта информация указана в каталогах, но длина волны флуорофоров также немного меняется в зависимости от условий раствора, таких как соленость, pH и внутриклеточные условия.Поэтому мы рекомендуем использовать флуорометр для измерения длин волн возбуждения и флуоресценции. Затем используйте эту информацию для выбора наиболее подходящих оптических элементов.
Выбор дихроичного зеркала
Выбор барьерного фильтра
Выберите фильтр, который пропускает длины волн флуоресценции от образца. Обычно фильтры с длинной полосой пропускания, которые пропускают длинные волны, выбираются по сравнению с полосовыми фильтрами. Однако полосовой фильтр, который не пропускает эти более длинные волны, часто используется в качестве барьерного фильтра при разделении длин волн от многократно окрашенного образца или при использовании камеры, чувствительной к более длинным волнам.
Выбор фильтра возбуждения
Комбинации барьерных фильтров и фильтров возбуждения
Идеальная комбинация барьерных фильтров и фильтров возбуждения — это комбинация, которая не пропускает свет. Излучаемая флуоресценция очень слабая, поэтому любой свет, просачивающийся через фильтры, снизит качество изображения.
Получение ярких флуоресцентных изображений
Иногда рекомендуется удалить нейтральный фильтр в оптике возбуждения и увеличить мощность возбуждающего источника света.Однако увеличение мощности источника возбуждающего света приведет к быстрому обесцвечиванию флуорофора и повреждению образца, а также к увеличению автофлуоресценции (примечание 2) в клетке. По этим причинам источник света должен быть как можно слабее, а оптика наблюдения должна быть максимально эффективной для улавливания сигнала флуоресценции (за счет расширения апертуры объектива, увеличения диапазона длин волн флуоресцентного фильтра, использования более чувствительной камеры. , так далее.).
[Примечание 1] Сдвиг Стокса относится к разнице в энергии между энергией возбуждения и флуоресцентной энергией, возникающей из-за частичной потери энергии в виде тепла, когда электроны возвращаются из возбужденного состояния в свое основное состояние во флуоресцентных материалах.(Из физико-химического словаря Иванами Сётэн)
[Примечание 2] Автофлуоресценция означает присутствие флуоресцирующих веществ в веществах, кроме тех, которые обычно определяются как флуоресцентные. Например, клеточные компоненты, такие как NAADPH или рибофлавин, излучают относительно сильную флуоресценцию в коротковолновом диапазоне (от ультрафиолетового до видимого) в неокрашенных клетках.

